ÁREA: Produtos Naturais
TÍTULO: Uma nova xantona dimérica isolada de fungo associado a "Duguetia stelechantha"
AUTORES: MENEZES, L.S. (UFAM) ; KOOLEN, H.H.F. (UFAM) ; PEREIRA, M.S. (UFAM) ; SOUZA, A.Q.L. (UEA) ; BARISON, A. (UFPR) ; NEPEL, A. (UFPR) ; SOUZA, A.D.L. (UFAM)
RESUMO: De uma coleção de fungos endofíticos isolados da planta medicinal "Duguetia stelechantha", foi selecionada a linhagem não identificada DgCr22.1b, esta linhagem em
trabalhos anteriores teve seus extratos testados biologicamente e apresentou elevada
atividade antitumoral em linhagens de células de leucemia e glioblastoma. Do
fracionamento do extrato em MeOH da massa micelial do fungo endofítico não identificado
DgCr22.1b foi obtida uma nova xantona dimérica inicialmente denominada phomoxantona C,
a identificação deste novo composto foi feita por análise de seus dados de RMN 1D e 2D
e espectrometria de massas.
PALAVRAS CHAVES: xantonas, fungos endifíticos, anticancerígenos
INTRODUÇÃO: Abundantes nas plantas, os fungos endofíticos estão entre os seres vivos menos
conhecidos do planeta, particularmente, do ponto de vista químico, apesar do
crescente aumento de interesse pelos seus metabólitos, especialmente após a
descoberta de fungos que podem produzir substâncias semelhantes às das suas
hospedeiras (ZHANG et al., 1997; STROBEL et al., 2004). As plantas do gênero
(Duguetia) pertencentes à família "Anonnaceae" apresentam vários relatos sobre sua
composição química principalmente pela presença de alcalóides e acetogeninas . Esses
compostos têm atividades biológicas comprovadas como antiparasitários, antitumorais,
inseticidas e antibacterianos (LEBOUF et al., 1982). Este trabalho descreve o
isolamento e determinação estrutural da phomoxantona C, uma nova xantona dimérica da
classe das ergocromonas.
MATERIAL E MÉTODOS: As partes coletadas da planta "Duguetia stelechantha" (folha, caule, inflorescência,
raiz e haste) foram submetidas a processo de desinfecção, o qual consistiu em
lavagem com detergente líquido e água corrente. Seguiu-se, em câmara asséptica, a
esterilização superficial com álcool 70%, tratamento com hipoclorito de sódio 3% por
4 minutos, nova imersão em álcool 70% por 30 segundos e finalmente a lavagem em água
destilada e autoclavada. O material vegetal foi cortado e os fragmentos, colocados em placas de petri contendo três meios de cultura (BDA + Ext. lev. 0,2%, aveia e ISP2).
Da água de lavagem 50 µL foram espalhados separadamente nos mesmos meios, para o
controle da assepsia. A partir do terceiro dia os fungos endofíticos foram isolados e
preservados pela metodologia de Castellani, em água com glicerol 15% e em óleo
mineral. Entre os fungos isolados, a linhagem DgCr22.1b foi selecionada para o
cultivo em larga escala no meio ISP2. O fungo foi cultivado por 30 dias em 60
erlenmeyers de 1 L contendo 300 mL de meio, após o período de fermentação o micélio
foi separado do líquido fermentado por filtração a vácuo, após seco a massa micelial
foi macerada em MeOH e em seguida o solvente concentrado fornecendo o extrato bruto.
O extrato foi sucessivamente fracionado em gel de sílica fase normal fornecendo a
fração DgD17 a qual foi submetida a fracionamento em CLAE semi-preparativo
fornecendo um sólido amarelo codificado como DgD16, esta amostra foi submetida a
posteriores análises espectroscópicas e espectrométricas (RMN 1H, 13C, HSQC, COSY,
HMBC em clorofórmio-d).
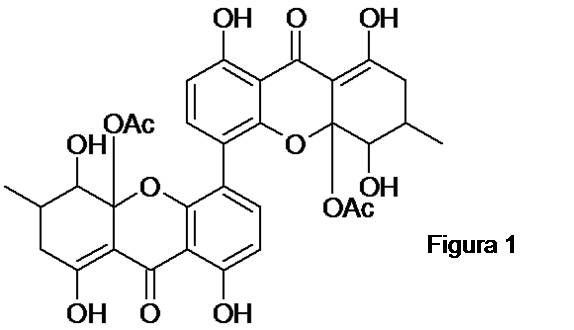
RESULTADOS E DISCUSSÃO: O espectro de RMN de 1H apresentou sinais de hidrogênios em 13,66 e 11,41 (s, 1H) que seriam um indicativo da presença de hidrogênios de hidroxila quelados, o que é típico em substâncias naturais tais como antraquinonas, também são observados dois dubletos em 8,04 e 6,60 com constantes de acoplamento 8,7 Hz, caracterizando hidrogênios em orientação orto entre si, além de sinais de hidrogênios alquílicos em 2,71 (dd, 1H), 2,27 (dd, 1H) e 2,42 (m, 1H). No espectro de RMN de 13C são observados sinais de hidrogênios carbonílicos em 177,1, e 169,9; aromáticos e olefínicos em 161,8, 155,6, 141,3, 115,2, 110,1, 106,9 e 101,1, bem como sinais de carbonos carbinólicos em 84,2 e 76,4 e sinais metilênicos e metílicos: 36,1, 29,0 e 17,9. Correlações entre o hidrogênio quelado de hidroxila em 13,66 e os carbonos em 36,1, 177,1 e 101,3 juntamente com 2,71 e 2,27 que por meio do mapa de HSQC mostrou se tratar de hidrogênios magneticamente diferentes ligados a um mesmo carbono, estes
correlacionando com diferentes carbonos vizinhos em 101,3, 177,1, 29,0, 17,9 e 76,4.
O hidrogênio do tipo carbinólico sobreposto em 3,74 apresentou correlações com os
carbonos 17,9, 29,0 e 84,8. Os hidrogênios aromáticos em 8,04 e 6,60 com constantes
de acoplamento 8,7 Hz, o primeiro apresentou correlação com o carbono 155,6 e o
segundo com 107,0, ao passo que ambos correlacionam com os carbonos 115,2 e 161,8. O
sinal em 11,41 referente a outro hidrogênio quelado apresentou correlações com os
carbonos 107,0, 110,1 e 161,8 indicando um anel tetrasubstituído, a proposta de um
dímero se deu com base no espectro de massas que indicou a massa 637 [M-H]- provando-
se de se tratava de um dímero com plano de simetria (Figura 1). Mais estudos a cerca dos metabólitos deste fungo estão sendo conduzidos.
CONCLUSÕES: O estudo químico da linhagem DgCr22.1b um endofítico de "Duguetia stelechantha" até o
momento levou ao isolamento de uma nova ergocromona denominada phomoxantona C. As
phomoxanthonas A e B previamente isoladas de Phomopsis sp. (Isaka et al., 2001)
apresentaram atividade anticâncer o que seria um indicativo que seria a phomoxantona C
a responsável pela atividade encontrada nos extratos brutos, mais estudos a cerca da
composição química do fungo bem como das atividades biológicas de suas moléculas são
necessários.
AGRADECIMENTOS: Os autores agradecem a Fundação de Amparo a Pesquisa do Estado do Amazonas (FAPEAM) e
ao Conselho Nacional de Desenvolvimen
REFERÊNCIAS BIBLIOGRÁFICA: STROBEL, G.; DAISY, B.; CASTILLO, U.; HARPER, J. Natural products from endophytic microorganisms. J. Nat. Prod., 2004.
ZHANG, W.; WENDEL, J. F.; & CLARK, L. G. Bamboozled again! Inadverted isolation of fungal rDNA sequences from bamboos (Poaceae: Bambusoideae). Molecular Phylogenetics and Evolution, 8(2): 205-217, 1997.
Lebouf, M.; Cavé, A.; Bhaumik, P.K.; Mukherjee, B.; Mukherjee, R.
Phytochemistry. 1982., 21: 2783.
M. Isaka, A. Jaturapat, K. Rukseree, K. Danwisetkanjana, M. Tanticharoen and Y. Thebtaranonth, J. Nat. Prod., 2001, 64,
1015–1018.
