ÁREA: Produtos Naturais
TÍTULO: ESTUDO COMPARATIVO DE MÉIS DE Apis mellifera E Melipona subnitida DA CAATINGA CEARENSE
AUTORES: CAVALCANTI, D.B. (UECE) ; MAGALHÃES, I.L. (UECE) ; LIBERATO, M.C.T.C. (UECE)
RESUMO: O Ceará, atualmente, é considerado um dos maiores produtores de mel de Apis mellifera
do Brasil. No entanto, existe na região um mel produzido pela abelha Melipona subnitida
conhecida como abelha Jandaíra muito usado pela população inclusive na medicina
popular. Nesse trabalho foram analisados os teores de fenóis totais pelo método de
Folin-Ciocalteau e as atividades antioxidantes (pelo método do DPPH) e
antiacetilcolinesterase de méis de Apis mellifera e de Melipona subnitida oriundos da
caatinga cearense.
PALAVRAS CHAVES: mel. apis mellifera. melipona subnitida
INTRODUÇÃO: INTRODUÇÃO: O mel é o produto das abelhas melíferas a partir do néctar das flores,
das secreções de partes vivas das plantas ou de excreções de insetos sugadores que
ficam sobre as plantas. A maioria das plantas produz néctar, usado pelas abelhas para
originar o mel e seus componentes bioativos podem ser transferidos para ele. Assim, a
composição e a capacidade antioxidante variam com a fonte floral usada para a coleta
de néctar e com fatores externos como clima, ambiente e processamento pelo qual tenha
passado (BALTRUŠAITYTĖ et al., 2007). A cobertura vegetal do estado do Ceará
constitui-se basicamente da caatinga, característica da região semi-árida nordestina,
rica em espécies que florescem ao longo do ano, apresentando grande potencial para a
apicultura. Essa região é rica em abelhas nativas, conhecidas como abelhas indígenas
sem ferrão, ou meliponíneos. A abelha nativa típica do Ceará é a Melipona subnitida
conhecida como abelha Jandaíra, produtora de um mel claro e muito usado pela
população, inclusive como medicamento natural. Os compostos fenólicos compreendem, no
mínimo, 8000 diferentes estruturas conhecidas, e são considerados produtos do
metabolismo secundário das plantas (GÓMEZ-CARAVACA et al., 2006), estando
relacionados com funções antioxidantes. O objetivo desse trabalho foi avaliar e
comparar os teores de fenóis totais e as atividades antioxidantes e
antiacetilcolinesterase de méis das abelhas Apis mellifera e Melipona subnitida
oriundos da caatinga cearense.
MATERIAL E MÉTODOS: Obtenção das amostras: As amostras foram obtidas de apicultores das regiões de
Barreira (mel de Melipona subnitida - Jandaíra) e Monsenhor Tabosa (mel de Apis
mellifera). Determinação do Teor de Fenóis Totais: 5g de amostra foi diluída com 50
mL de água destilada. 0,5 dessa solução foi agitada com 2,5 mL do Reagente de Folin-
Ciocalteau por 5 min. e 2 mL de Carbonato de Sódio (75 g/L) foi adicionado. Após
incubação a temperatura ambiente por 2 h, a absorbância foi lida a 760 mm contra um
branco de metanol. Ácido gálico foi usado como padrão para a construção da curva de
calibração. A média de 3 leituras foi usada, e o resultado foi expresso em mg de
equivalentes de ácido gálico (EAG)/100 g de mel. As análises foram feitas em
triplicatas (SINGLETON et al., 1999). Determinação da Atividade Antioxidante: 1,25 mL
de uma solução de mel (0,025 g/mL) foi agitada com 1,5 mL de solução de DPPH (90
mg/L) em metanol. Após 15 min. de incubação a absorbância foi lida a 517 nm contra um
branco de água/metanol (1:1). A atividade anti-radical livre foi calculada como
segue: percentagem de inibição = [(absorbância do branco – absorbância da amostra)
/absorbância do branco] X 100. As análises foram feitas em triplicatas. Determinação
da Atividade Antiacetilcolinesterase: Foram usadas soluções de ácido 5,5’-ditiobis-2-
nitrobenzóico (DTNB) e iodeto de acetilcolina (ATCI) em tampão. As amostras foram
aplicadas na cromatoplaca. Após evaporação do solvente, pulverizou-se o substrato
(ATCI, 1mM em tampão) e o reagente de Ellman (DTNB, 1 mM em tampão). Após 3 a 5 min.
borrifou-se a enzima (3U/mL) e em 10 min. a placa desenvolveu cor amarela. Halos
brancos apareceram em torno das amostras indicando inibição, foram medidos e
comparados com o padrão (RHEE et al, 2001).
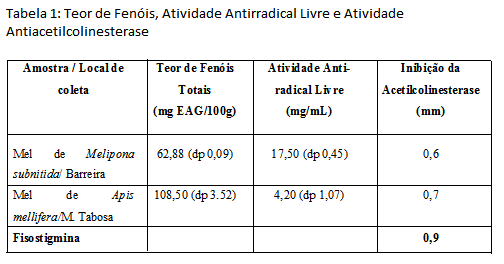
RESULTADOS E DISCUSSÃO: O teor de fenóis totais para o mel heterofloral da abelha Melipona subnitida
(Jandaíra) oriundo da região de Barreira foi: 62,88 mais ou menos 0,09 mg EAG/100g,
enquanto para o mel monofloral de Lippia sidoides da abelha Apis mellifera oriundo de
Monsenhor Tabosa foi 108,50 mais ou menos 3.52 mg EAG/100g. Quanto à atividade anti-
radical livre para o mel heterofloral da abelha Melipona subnitida (Jandaíra) oriundo
de Barreira foi: 17,50 mais ou menos 0,45 mg/mL enquanto para o mel monofloral de
Lippia sidoides da abelha Apis mellifera oriundo de Monsenhor Tabosa foi 4,20 mais ou
menos 1,07 mg/mL. Os valores encontrados estão disponíveis na tabela 1. Quanto à
atividade antiacetilcolinesterase, o mel de Jandaíra de Barreira apresentou um halo
de inibição da enzima de 0,6 mm enquanto o mel de Apis mellifera apresentou halo de
0,7 mm. O halo do alcalóide Fisostigmina usado como controle foi de 0,9 mm. Embora
diferentes espécies botânicas apresentem diferentes compostos fenólicos e, portanto,
apresentem variações no teor de fenóis totais e nas atividades anti-radical livre os
resultados observados são semelhantes aos encontrados para amostras de mel analisadas
por MEDA et al. (2005). Com relação à atividade antiacetilcolinesterase os estudos
da inibição em méis estão apenas iniciando. Pelos resultados apresentados pode-se
observar que a origem botânica bem como a espécie de abelha pode ter influenciado
quanto às diferenças observadas.
CONCLUSÕES: As amostras de méis analisadas apresentaram resultados semelhantes aos encontrados na
literatura, tanto para os teores de fenóis apresentados como para a atividade anti-
radical livre, sendo considerados excelentes. Com relação à atividade
antiacetilcolinesterase embora os valores dos halos sejam inferiores aos do alcalóide
fisostigmina, usado como padrão, observou-se alguma inibição. As diferenças existentes
entre os resultados obtidos nos méis analisados podem estar relacionadas com a espécie
de abelha e as origens botânicas das plantas por elas visitadas.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: BALTRUŠAITYTĖ, V., VENSKUTONIS, P. R., ČEKSTERYTĖ, V. (2007). Radical Scavenging Activity of Different Floral Origin Honey and Beebread Phenolic Extracts. Food Chemistry, 101. p.502-514.
GÓMEZ-CARAVACA, A. M., GÓMEZ-ROMERO, M., ARRÁEZ-ROMÁN, D., SEGURA-CARRETERO, A. FERNÁNDEZ-GUTIÉRREZ, A. 2006. Advances in the analysis of phenolic compounds in products derived from bees. Journal of Pharmaceutical and Biomedical Analysis, 41: 1220-1234.
MEDA, A., LAMIEN, C. E., ROMITO, M., MILLOGO, J., NACOULMA, O. G. (2005). Determination of the Total Phenolic, Flavonoid and Proline Contents in Burkina Fasan Honey, as well as their Radical Scavenging activity. Food Chemistry, 91, p. 571-577.
RHEE, I. K., MEENT, M., INGKANINAN, K., VERPOORTE, R. 2001. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. Journal of Chromatography A 915: 217-223.
SINGLETON, V. L., ORTHOFER, R., LAMUELA-RAVENTOS, R. M. 2002. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods in Enzymology, 299: 152-178.
