ÁREA: Química Tecnológica
TÍTULO: INTERAÇÃO DA LACTOFERRINA DE SORO DE BOVINO COM COBRE II COMPLEXADO EM MATRIZ DE CRIOGEL DE POLIACRILAMIDA
AUTORES: CARVALHO, B.M.A (UFV) ; MINIM, L.A (UFV) ; DA SILVA, L.H.M (UFV) ; DA SILVA, M.C.H (UFV) ; MINIM, V.P.R (UFV) ; CARVALHO, L.M (UFV)
RESUMO: RESUMO: Dados de adsorção sob várias condições de pH (6-8) e força iônica (200-1000mM) foram analisados usando quatro modelos de isotermas; a teoria geral da interação por afinidade/modelos de Langmuir, Freundlich, Temkin e o Langmuir-Freundlich. Embora todos os modelos tenham sido capazes de explicar o sistema lactoferrina-criogel-IDA-CuII, o modelo de Langmuir-Freundlich foi o mais eficiente para explicar a interação da lactoferrina com o criogel-IDA-CuII. Além disso, este modelo foi capaz de explicar a cooperatividade e a heterogeneidade das ligações em termos quantitativos. Esta análise se torna útil no desenvolvimento de uma melhor compreensão da interação proteína-íon metálico imobilizado além de fornecer suporte para criação de projetos em escalas preparativas utilizando IMAC.
PALAVRAS CHAVES: imac, adsorção de proteína, separação.
INTRODUÇÃO: INTRODUÇÃO: A lactoferrina (LF) do soro de queijo é uma glicoproteína com massa molar em torno de 80 kDa da família das transferrina, contém um átomo de ferro ligado à molécula, além de resíduos de aminoácidos (como histidina e triptofano) expostos em sua superfície. Dado sua ampla gama de aplicações na medicina, biologia, indústria farmacêutica e alimentícia, muitas tecnologias de processamento foram estudadas e desenvolvidas para o isolamento da LF em níveis de pureza elevados.
Criogéis possuem supermacroporosos interconectados de tamanhos que variam entre 10 a 100 µm. Estas colunas cromatográficas com poros suficientemente grandes podem permitir que soluções contendo fragmentos celulares e materiais particulados em geral possam ser escoados pela coluna sem sua obstrução Lozinsky et al., 2002.
A técnica de cromatografia de afinidade por íons metálicos imobilizados (IMAC), baseia-se na afinidade diferencial que íons metálicos imobilizados em uma matriz sólida apresentam por certos grupamentos expostos na superfície de uma molécula em solução. O uso de colunas cromatográficas supermacroporosas, como criogéis, unidos à técnica de cromatografia de afinidade por íons metálicos imobilizados (IMAC), parece ser, então, uma alternativa promissora para captura da lactoferrina. Diante do proposto, neste trabalho foi avaliado a adsorção em tanques agitados da proteína, lactoferrina, em matriz supermacroporosa de criogel imobilizada com Cu2+, em diferentes concentrações de sal NaCl (200, 400, 600, 800 e 1000mM) e pH’s (6,0; 7,0 e 8,0).
MATERIAL E MÉTODOS: MATERIAIS E MÉTODOS: MATERIAIS: Lactoferrina (80kDa e pI 7,8), Acrilamida (AAm, 99.9% grau eletroforético), N,N'-Metilenobisacrilamida (MBAAm, 99%), Per-sulfato de Amônio (APS, 98%), CuSO4•4H2O (98%), ácido Iminodiacético (IDA), N-2 Hidroxietil Piperazina-N’-2-Acido Etanosulfênico (HEPES), N,N,N',N'- Tetrametil-etilenodiamina (TEMED, 99%) e alil glicidil eter (AGE, 99%) foram adquiridos da Sigma- Aldrich (Steinheim, Germany). Imidazol foi adquirido da Merck (Germany). Durante os experimentos foram utilizados água ultrapura (sistema Milli-Q, Millipore Inc., USA).
MÉTODOS: A formação da matriz de criogel foi feita de acordo com Kumar et al., 2006. O carregamento do criogel com íons de cobre II seguiu procedimento descrito por Arvidsson et al., 2003.
Os dados experimentais para obtenção das isotermas de adsorção da lactoferrina foram obtidos através de ensaios em tanques agitados. Para cada condição experimental os valores de pH e concentração de sal permaneciam constantes.
A modelagem dos dados de equilíbrio sob as várias condições de pH (6-8) e força iônica (200-1000mM) foi realizada usando quatro modelos de isotermas; a teoria geral da interação por afinidade/modelos de Langmuir, Freundlich, Temkin e o Langmuir-Freundlich.
Os experimentos foram realizados segundo um delineamento experimental inteiramente casualizado em esquema fatorial (5 x 3) com três valores de pH (6, 7 e 8) e cinco concentrações de sal (200, 400, 600, 800 e 1000mM), constituído de 15 tratamentos.
RESULTADOS E DISCUSSÃO: RESULTADOS E DISCUSSÃO: A relação do conteúdo de proteína adsorvida (q*) vs concentração de proteína no equilíbrio (C*) demonstrou que a adsorção da proteína decresce com o aumento da força iônica. As capacidades de adsorção foram significativamente elevados na concentração de 200mM NaCl, assim, a adição de 200mM de NaCl no tampão de equilíbrio parece ser a melhor condição para alcançar maior capacidade de ligação.
O papel do pH no comando da adsorção da lactoferrina em criogel-IDA-Cu2+ também foi investigado. Estes estudos são importantes devido ao fato da mudança de pH ser um dos métodos mais comuns utilizados para a eluição de proteínas em géis IMA. O aumento das capacidades de adsorção foi observado com o aumento do pH no intervalo (6-8) estudado.
Dentre os modelos de isotermas estudados neste trabalho, o modelo de Langmuir-Freundlich apresentou melhor ajuste nos dados experimentais de equilíbrio de adsorção nas condições avaliadas (Tabela 1). O valor de n>1 em todas as forças iônicas estudadas, exceto em 200mM, indicam cooperatividade positiva na ligação e uma adsorção de natureza heterogênea. Este modelo é apropriado para explicar de maneira quantitativa o mecanismo de adsorção da proteína em condições de alta força iônica, em termos do parâmetro, n. O valor de n aumenta com o aumento da força iônica, indicando um aumento da cooperatividade na ligação. Apesar do aumento da afinidade de ligação com a força iônica, a capacidade máxima de sorção passa por um máximo em 400mM de NaCl.
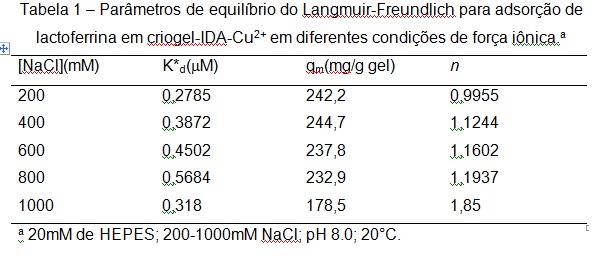
CONCLUSÕES: CONCLUSÃO: Os resultados desta pesquisa possuem implicações gerais importantes sobre a concepção de um processo de separação usando IMAC. Como o modelo de Langmuir-Freundlich aparece como o modelo mais adequado para explicar as interações de adsorção em IMAC, os parâmetros de sorção de Langmuir-Freundlich podem ser considerados como verdadeiros representantes da natureza das interações proteína-íon metálico imobilizado. Esses parâmetros devem, portanto, serem úteis na elaboração de separações eficazes em IMAC em escala preparativa e predizer o desempenho com antecedência.
AGRADECIMENTOS: AGRADECIMENTO: Ao CNPq pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: ARVIDSSON, P.; PLIEVA, F.M.; LOZINSKY, V.I.; GALAEV, I.Y.; MATTIASSON, B. 2003. Direct chromatographic capture of enzyme from crude homogenate using immobilized metal affinity chromatography on a continuous supermacroporous adsorbent, Journal of Chromatography A 986 275–290.
KUMAR, A.; BANSAL, V.; ARVIDSSON, P.; ROYCHOUDHURY, P.K.; MATTIASSON, B. 2006. Supermacroporous cryogel matrix for integrated protein isolation immobilized metal affinity chromatographic purification of urokinase from cell culture broth of a human kidney cell line, Journal of Chromatography A 1103 35–42.
LOZINSKY, V.I. 2002. Cryogels on the basis of natural and synthetic polymers: preparation, properties and areas of implementation. Russ. Chem. Rev. 71, 489–51.
