ÁREA: Química Tecnológica
TÍTULO: MODELO SMA (STERIC MASS-ACTION) PARA ADSORÇÃO DE LACTOFERRINA EM COLUNAS MONOLÍTICAS SUPERMACROPOROSAS IMOBILIZADAS COM ÍONS DE COBRE
AUTORES: CARVALHO, B.M.A (UFV) ; MINIM, L.A (UFV) ; DA SILVA, L.H.M (UFV) ; CARVALHO, L.M (UFV) ; DA SILVA, M.C.H (UFV) ; MINIM, V.P.R (UFV)
RESUMO: RESUMO: Usando os parâmetros do equilíbrio de adsorção obtidos de dados experimentais da interação de lactoferrina de soro bovino em criogel contínuo supermacroporoso imobilizado com íons de Cu2+ foi analisada a aplicabilidade do modelo SMA (steric mass-action) para descrever o equilíbrio por afinidade da proteína nas diferentes condições analisadas. Os resultados encontrados para os parâmetros do modelo, isto é, a constante de equilíbrio (K), o número característico de sítios de ligação (n) e fator estérico (s) mostraram que K e n diminuíram com o aumento da força iônica, do pH e temperatura, enquanto ao parâmetro não linear,fator estérico, aumentou com a força iônica e temperatura.
PALAVRAS CHAVES: imac, modelagem, sma
INTRODUÇÃO: INTRODUÇÃO: Exigências de alta pureza na purificação de proteínas tanto naturais como recombinantes, juntamente com a necessidade de se reduzir os custos de processos downstream tem estimulado, nos últimos anos, o desenvolvimento de técnicas de separação mais eficientes e relativamente mais baratas. A cromatografia de afinidade em íons metálicos imobilizados(IMAC) pertence a esta categoria. Esta é baseada na afinidade química exibida por certos grupos de cadeia lateral (por exemplo, grupo imidazol da histidina, grupo tiol da cisteína e grupo indol do triptofano) sobre a superfície da proteína com os íons metálicos imobilizados em um suporte fixo.
Embora a interação de adsorção em IMAC seja consideravelmente diferente da adsorção convencional, estudos anteriores demonstraram que a interação entre uma molécula de proteína e os íons metálicos imobilizados pode ser explicada com base na aplicação de modelos de isoterma de vários suportes de afinidade e de troca iônica (Belew et al., 1987, Todd et al., 1994). No entanto a aplicabilidade universal de um modelo na elucidação de mecanismos moleculares precisos por onde proteínas são seletivamente retidas em gel IMA continua a ser estabelecido.
Na década de 1990, Brooks e Cramer apresentaram um novo modelo, steric massa action (SMA). Este modelo é semiempírico e seus parâmetros só podem ser determinados experimentalmente (Brooks e Cramer, 1992; Chen, 2002). Os parâmetros do modelo e adequações são, influenciados pela condição do meio. Assim, no presente trabalho, a aplicabilidade do modelo SMA e sensibilidade paramétrica para descrever o equilíbrio por afinidade da lactoferrina de soro bovino em matriz de criogel-IDA-Cu2+ em diferentes condições de pH, concentração de sal e temperatura foram analisados e discutidos.
MATERIAL E MÉTODOS: MATERIAL E MÉTODOS: MATERIAIS: Lactoferrina (80kDa e pI 7,8) – Sigma Aldrich, adsorvente criogel-IDA-Cu2+ sintetizado no laboratório de desenvolvimento e simulação de processos da Universidade Federal de Viçosa - UFV. A matriz adsortiva possui diâmetro médio de poros de 10-100nm. Os reagentes químicos utilizados foram de alto grau cromatográfico e a água purificada pelo sistema Milli-Q.
MÉTODOS: Os dados experimentais para obtenção das isotermas de adsorção da lactoferrina foram obtidos através de ensaios em tanques agitados. Para cada condição experimental os valores de pH e concentração de sal permaneciam constantes.
Neste trabalho, o equilíbrio de adsorção da lactoferrina como proteína modelo foi estudado para examinar a utilidade do modelo SMA que, para este sistema, pode ser então reduzida para:
C=Q/K[Lt-(f+n)Q]^n (1)
A equação 1 indica que o modelo SMA envolve três parâmetros (K, n e f) para cada solução, semelhante ao desenvolvido por Brooks e Cramer para sistemas de troca iônica. Em uma solução diluída de proteínas, a concentração C, se aproxima de zero e, portanto, Q se aproxima de zero. Como resultado, a isoterma se reduz a:
K=lim Q/CLnt (2)
A Equação acima é usada para determinar os parâmetros do modelo linear K e n que serão discutidos mais adiante.
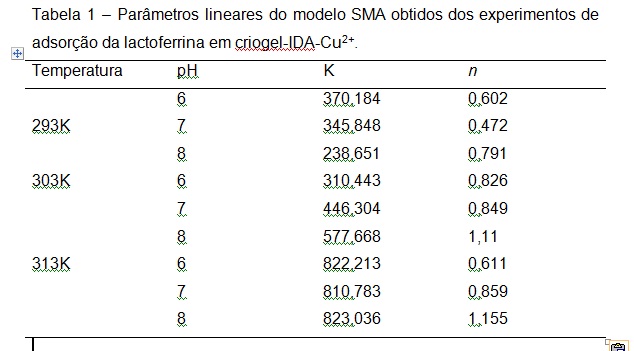
RESULTADOS E DISCUSSÃO: RESULTADOS E DISCUSSÃO: A Tabela 1 apresenta os valores dos dois parâmetros lineares do modelo SMA de acordo com a temperatura e pH. Verifica-se que, o parâmetro n aumenta com o aumento do pH e, os valores do parâmetro K, exceto para o pH 6 aumentaram com o aumento da temperatura.
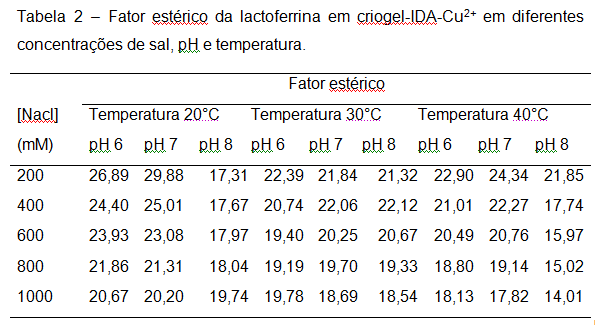
Uma vez que os parâmetros lineares K e n foram determinados, o fator estérico pode ser estimado, minimizando a soma de quadrados dos desvios obtidos com a isoterma SMA da equação (1) (Gallant, 1995 e 1996). Os fatores estéricos assim obtidos são apresentados na Tabela 2. Para a maioria dos casos estudados o valor do fator estérico diminuiu com o aumento da temperatura, sendo que, em alguns casos, os valores passam por um mínimo na temperatura 30°C. Quando ocorre a elevação da temperatura no processo de adsorção, ocorre uma diminuição nas energias de interação proteína-água o que acarreta no aumento das interações por coordenação íon-proteína. Dessa forma o aumento na temperatura é suficiente para desestruturação da região difusa da dupla camada elétrica e, assim, as moléculas de proteína interagem mais fortemente com a resina o que favorece o fenômeno adsortivo.
CONCLUSÕES: CONCLUSÃO: O modelo SMA foi aplicado no equilíbrio de adsorção da lactoferrina em criogel-IDA-CuII. Os resultados das simulações mostraram que, em elevada temperatura e pH próximo do ponto isoelétrico da proteína a precisão da previsão do modelo diminuiu devido à outros tipos de interações que não só por afinidade que pode ocorrer nessas condições. O modelo SMA se mostrou promissor na predição de isotermas de adsorção de proteínas por afinidade em íons metálicos imobilizados. Porém ainda pode ser melhorado, levando em consideração a influência de fatores que influenciam a estrutura da proteína
AGRADECIMENTOS: Ao CNPq pelo apoio financeiro
REFERÊNCIAS BIBLIOGRÁFICA: REFERÊNCIAS BIBLIOGRÁFICAS:
BELEW, M.; YIP, T.T.; ANDERSSON, L. and PORATH, J. 1987. Interaction of proteins with immobilized Cu2+: Quantitation of adsorption capacity, adsorption isotherms and equilibrium constants by frontal analysis. Journal. Chromatography A 403, 197–206.
C.A. BROOKS, S.M. CRAMER. 1992. Steric mass-action ion exchange: Displacement profiles and induced salt gradients. AIChE J. 38.
TODD, R.J.; JOHNSON, R.J.; and ARNOLD, F.H. 1994. Multiple-site binding interactions in metal-affinity chromatography: I. Equilibrium binding of engineered histidine-containing cytochromes c. Journal Chromatography A 662, 13–26.
GALLANT, S.R.; KUNDU, A.; CRAMER, S.M. 1995. Optimization of step gradient separations: Consideration of nonlinear adsorption. Biotechnol. Bioeng. 47 355.
GALLANT, S.R.; VUNNUM, S.; CRAMER, S.M. 1996. Optimization of preparative ion-exchange chromatography of proteins: linear gradient separations. Journal of Chromatography A 725 295.
