ÁREA: Química Orgânica
TÍTULO: Alilação de compostos carbonílicos utilizando aliltrifluoroborato de potássio catalisada por Amberlyst-15
AUTORES: Curcino, F.C.A. (UFPE) ; Silva, I.H.C. (UFPE) ; Freitas, J.C.R. (UFPE) ; Couto, T.R. (UFPE) ; Oliveira, R.A. (UFPE) ; Menezes, P.H. (UFPE)
RESUMO: Este trabalho descreve a utilização da Amberlyst-15 na alilação de aldeídos
com aliltrifluoroborato de potássio. A resina A-15 foi utilizada como catalisador
para promover a adição à carbonila. O método mostrou-se robusto para uma série de
aldeídos em meio aquoso, no qual os alcoóis homoalílicos correspondentes foram
obtidos em rendimentos elevados, tempos reacionais curtos, à temperatura ambiente
e sem purificações adicionais.
PALAVRAS CHAVES: Amberlyst-15; Trifluoroboratos; Reação de Alilação
INTRODUÇÃO: A Amberlyst-15 é uma resina altamente reticulada a base de poliestireno
funcionalizada com grupos sulfônicos.[1] Devido as suas propriedades, como,
elevado diâmetro de poro e boa constante de acidez de Hammet,[2] permite ser
utilizada em inúmeras reações de catálise heterogênea. Nesta perspectiva, a A-15
pode ser aplicada na síntese de Bohlmann-Rahtz,[3] em reações de esterificação,
[4] na síntese de α-hidróxi fosfonato,[5] e na proteção de alcoóis.[6]
Em paralelo, a reação de alilação e crotilação de compostos carbonílicos é
um dos métodos mais importante para a construção de novas ligações C-C.[7] Seus
produtos de adição, os alcoóis homoalílicos, são versáteis intermediários
sintéticos na síntese de moléculas biologicamente ativas.[8]
Nestes tipos de adição nucleofílica, geralmente espécies organometálicas de
lítio (RLi) ou Grignard (RMgBr), que são sensíveis ao ar e água estão
envolvidas, o que torna a síntese empregando estes reagentes limitada.[9] Neste
aspecto, os organotrifluoroboratos de potássio provaram ser uma boa opção, pois
este reagente pode ser estocado sem cuidados adicionais, são facilmente
manipulados, além de serem estáveis ao ar.[10]
Assim, neste trabalho é descrita uma metodologia que utiliza água como co-
solvente na síntese de vários alcoóis homoalílicos a partir da alilação de
diversos aldeídos por aliltrifluoroborato de potássio na presença de Amberlyst-
15 como catalisador.
MATERIAL E MÉTODOS: Material e Instrumentação
Em todas as reações foram utilizados solventes e reagentes na sua forma
comercial (P.A.). A cromatografia em camada delgada (CCD) foi realizada
utilizando-se placas de sílica-gel contendo indicador de fluorescente GF254.
Para visualização das CCD, foi utilizada luz ultravioleta, vapor de iodo e
solução ácida de vanilina. Os espectros de Ressonância Magnética Nuclear de 1H
(300 MHz), 13C (75 MHz), 19F (282 MHz) e 11B (96 MHz) foram obtidos em um
espectrofotômetro, utilizando clorofórmio deuterado (CDCl3) e dimetilsulfóxido
deuterado (DMSO-d6) como solventes e os deslocamentos químicos expressos em
partes por milhão. Os espectros de massas de baixa resolução foram realizados em
um aparelho, operando com energia de ionização de 70 eV, hélio 4.5 como gás de
arraste e uma coluna DB-5 de 30 m X 0,25 μm de espessura do filme. Os espectros
de infravermelho foram obtidos em espectrofotômetro de IV com Transformada de
Fourier, sendo as amostras preparadas como filmes finos ou pastilhas de KBr.
Metodologia
Em um balão de 10 mL contendo o aliltrifluoroborao de potássio (163 mg,
1,10 mmol) e o aldeído apropriado (1,0 mmol) foi adicionado CH2Cl2 (3,00 mL) e
H2O (3,00 mL), seguido da adição da Amberlyst-15 (50% M/M). A mistura bifásica
foi agitada durante o tempo indicado na Tabela 1. Após o término da reação a
fase orgânica foi separada, extraída com CH2Cl2 (3 x 5 mL) e secada com MgSO4. O
solvente foi removido sob pressão reduzida fornecendo os alcoóis homoalílicos
correspondentes em excelentes rendimentos e sem purificação adicional.
RESULTADOS E DISCUSSÃO: Na primeira etapa do trabalho foi realizado um estudo para avaliar a
quantidade catalítica da resina Amberlyst-15 necessária para promover a reação
de alilação. Neste sentido, foram utilizados como reagentes, o p-
nitrobenzaldeído e o alilitrifluoroborato de potássio (2) em um sistema bifásico
H2O:CH2Cl2, na proporção de 1:1 (Esquema 1).
O estudo demonstrou que utilizando uma quantidade de 50% M/M de A-15, a
reação de alilação aconteceu em 15 minutos com um rendimento de 94%. Este baixo
tempo reacional deve-se provavelmente ao fato da resina apresentar sítios ativos
que podem estabelecer ligações intermoleculares com o aldeído, tornando o
carbono da carbonila mais eletrofílico.
Para verificar a robustez desta reação a metodologia foi então estendida
para diversos aldeídos, e em todos os casos foram observados baixos tempos
reacionais e excelentes rendimentos (Tabela 1).
De acordo com a tabela 1, aparentemente a natureza eletrônica dos
substituintes nos aldeídos aromáticos não influencia na reação, pois tanto para
grupos doadores como retiradores de elétrons os tempos reacionais são
equivalentes (entrada 1 e 2). A reação também é robusta para aldeídos alifáticos
(Tabela 1, entrada 6) e aldeídos heterocíclicos (Tabela 1, entrada 5), apesar de
um pequeno aumento do tempo reacional.
Esquema 1.
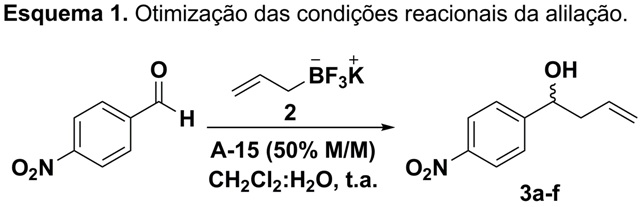
Otimização das condições reacionais da alilação
Tabela 1
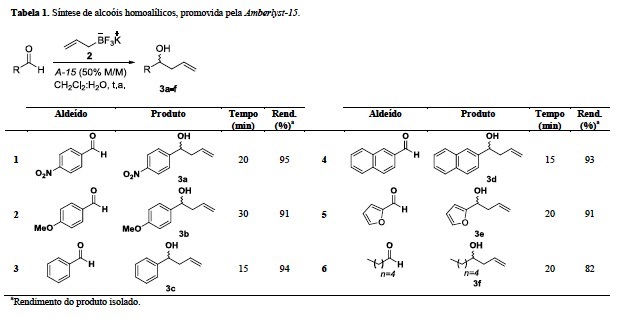
Síntese de alcoóis homoalílicos, promovida pela Amberlyst-15.
CONCLUSÕES: Foi descrito uma catálise heterogênea utilizando a Amberlyst-15 como
catalisador para a reação de alilação de aldeídos por aliltrifluoroborato de
potássio. A metodologia é eficiente, rápida, utiliza água como co-solvente e
tolera aldeídos alifáticos e aromáticos contendo diversos grupos funcionais. Novos
estudos estão em andamento, visando ampliar os resultados para outros aldeídos,
imidas e aldiminas.
AGRADECIMENTOS: Os autores agradecem a Universidade Federal de Pernambuco e aos órgãos de
fomento FACEPE, CAPES e CNPq.
REFERÊNCIAS BIBLIOGRÁFICA: [1] (a) Abonia, R.; Cuervo, P.; Insuasty, B.; Quiroga, J.; Nogueras, M.; Cobo, J.; Meier, H.; Lotero, E. J. Open Org. Chem. 2008, 2, 26-34; (b) Mazzotti, M.; Neri, B.; Gelosa, D.; Kruglov, A.; Morbidelli, M. Ind. Eng. Chem. Res. 1997, 36, 3-10.
[2] Harmer, M.A.; Sun, Q. Appl. Catal., A 2001, 221, 45-62.
[3] Tajbakhsh, M.; Heydari, A.; Khalilzadeh, M. A.; Lakouraj, M. M.; Zamenian, B.; Khaksar, S. Synlett 2007, 2347-2350.
[4] (a) Lópes, D. E.; Goodein Jr, J. G.; Bruce, D. A.; Loreto, E. Appl. Catal., A 2005, 297, 97-122; (b) (d) Sternberg, V.; Vesley, G.; Kubik, D. J. Org. Chem. 1971, 36, 2550-2551.
[5] Bagley, M. C.; Dale, J. W.; Bower, J. Synlett 2001, 1149-1151.
[6] Choi, J.-E.; Ko, K.-Y. Bull. Korean. Chem. Soc. 2001, 1177-1178.
[7] Nowrouzi, F.; Thadani, A. N.; Batey, R. A. Org. Lett. 2009, 11, 2631-2634.
[8] de Fátima, A.; Robello, L. G.; Pilli, R. A. Quim. Nova 2006, 29, 1009-1026.
[9] (a) Yamamoto, Y.; Asao, N. Chem. Rev. 1993, 93, 2207–2293; (b) Denmark, S. E.; Fu, J. Chem. Rev. 2003, 103, 2763–2793.
[10] Thadani, A. N.; Batey, R. A. Org. Lett. 2002, 4, 3827-3830.
