ÁREA: Química Orgânica
TÍTULO: Desenvolvimento de uma metodologia verde para a alilação do 2-naftaldeído
AUTORES: Silva, I.H.C. (UFPE) ; Cursino, F.C.A. (UFPE) ; Couto, T.R. (UFPE) ; Freitas, J.C.R. (UFPE) ; Oliveira, R.A. (UFPE) ; Menezes, P.H. (UFPE)
RESUMO: Este trabalho descreve a utilização de diversas resinas na reação de alilação do
2-naftaldeído com aliltrifluoroborato de potássio. A resina A-15 apresentou
melhores resultados como agente catalítico, sendo utilizada no desenvolvimento
preliminar de uma metodologia para promover a adição à carbonila. O estudo das
condições reacionais levou à formação do álcool homoalílico correspondente com
elevados rendimentos, tempos reacionais curtos, à temperatura ambiente e sem
purificações adicionais.
PALAVRAS CHAVES: Alilação; Trifluoroboratos; Resinas
INTRODUÇÃO: Formar novas ligações C-C em condições menos agressivas ao meio ambiente é um
grande desafio atualmente.[1] Para atingir esse objetivo, várias metodologias
empregam compostos com limitações sintéticas, como por exemplo, sensibilidade à
umidade.[2]
A reação de alilação e crotilação de compostos carbonílicos é um dos métodos
mais importantes para a construção de novas ligações C-C.[3] Seus produtos de
adição, os alcoóis homoalílicos, são versáteis intermediários sintéticos na
síntese de moléculas biologicamente ativas.[4]
Nestes tipos de adição nucleofílica, geralmente espécies organometálicas de
lítio (RLi) ou Grignard (RMgBr), que são sensíveis ao ar e água estão
envolvidas, o que torna a síntese limitada.[5] Neste aspecto, os
organotrifluoroboratos de potássio provaram ser uma boa alternativa como
reagentes, pois podem ser estocados sem cuidados adicionais, são facilmente
manipulados, além de serem estáveis ao ar.[6]
Assim, estudou-se uma metodologia técnica e economicamente viável e de baixo
impacto ambiental, aplicando resinas insolúveis como catalisadores.
A metodologia desenvolvida utiliza água como co-solvente na síntese de um álcool
homoalílico a partir da alilação do 2-naftaldeído por aliltrifluoroborato de
potássio na presença de diversas resinas como catalisadores.
MATERIAL E MÉTODOS: Material e Instrumentação
Em todas as reações foram utilizados solventes e reagentes na sua forma
comercial (P.A.). A cromatografia em camada delgada (CCD) foi realizada
utilizando-se placas de sílica-gel contendo indicador de fluorescente GF254.
Para visualização das CCD, foi utilizada luz ultravioleta, vapor de iodo e
solução ácida de vanilina. Os espectros de Ressonância Magnética Nuclear de 1H
(300 MHz), 13C (75 MHz), 19F (282 MHz) e 11B (96 MHz) foram obtidos em um
espectrofotômetro, utilizando clorofórmio deuterado (CDCl3) e dimetilsulfóxido
deuterado (DMSO-d6) como solventes e os deslocamentos químicos expressos em
partes por milhão. Os espectros de massas de baixa resolução foram realizados em
um aparelho, operando com energia de ionização de 70 eV, hélio 4.5 como gás de
arraste e uma coluna DB-5 de 30 m X 0,25 μm de espessura do filme. Os espectros
de infravermelho foram obtidos em espectrofotômetro de IV com Transformada de
Fourier, sendo as amostras preparadas como filmes finos ou pastilhas de KBr.
Metodologia
Em um balão de 10 mL contendo o aliltrifluoroborato de potássio (163 mg, 1,10
mmol) e o 2-naftaldeído (156 mg, 1,0 mmol) foi adicionado CH2Cl2 (3,00 mL) e H2O
(3,00 mL), seguido da adição da respectiva resina (100% M/M). A mistura bifásica
foi agitada durante o tempo indicado na Tabela 1. Após o término da reação a
fase orgânica foi separada, extraída com CH2Cl2 (3 x 5 mL) e secada com MgSO4. O
solvente foi removido sob pressão reduzida fornecendo o álcool homoalílico
correspondente sem purificação adicional.
RESULTADOS E DISCUSSÃO: Inicialmente foi realizado um estudo para avaliar qual resina levaria aos
melhores resultados na reação de alilação. Foram utilizadas as seguintes
condições iniciais:
- Solvente CH2Cl2:H2O na proporção de 1:1;
- Quantidade de catalisador 1:1 (m/m) entre o 2-naftaldeído e o catalisador.
Os resultados da Tabela 1 levaram à escolha da Amberlyst A-15 como catalisador.
Assim, o próximo passo foi realizar um estudo da influência da quantidade dos
solventes na velocidade da alilação. Os resultados são mostrados na Tabela 2.
Com base na Tabela 2, pode-se inferir que a A-15 atua como catalisador de
transferência de fase entre a água e o CH2Cl2. Neste caso, se fez importante a
presença de água para solubilizar o sal de potássio e de CH2Cl2 para solubilizar
o aldeído.
Após a escolha do catalisador (A-15) e quantidade de solvente ideais (0,5 mL/0,5
mL), a terceira etapa foi analisar a interferência da quantidade de catalisador
no andamento da reação. Foram realizados testes utilizando-se as seguintes
quantidades do catalisador (tempo reacional e rendimento associados a cada
teste):
- 50% m/m (25 min, 90%); 100% m/m (15 min, 93%); 200% m/m (15 min, 92%); 500%
m/m (10 min, 80%)
Os resultados mostraram que a variação na quantidade de A-15 não influenciou
significativamente nos resultados, podendo a reação ser feita com uma quantidade
pequena (100% m/m) do catalisador. Como a A-15 é insolúvel, tanto no CH2Cl2,
quanto na água, ela pode ser removida por filtração simples, além disso a reação
leva ao consumo total do aldeído e não forma subprodutos. Sendo assim, não foi
necessária purificação posterior.
Tabela 1.
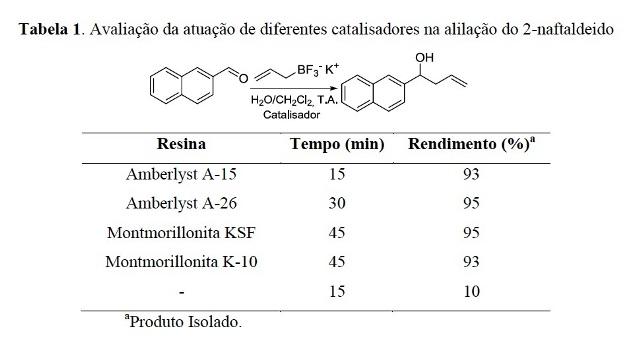
Avaliação da atuação de diferentes catalisadores na
alilação do 2-naftaldeido.
Tabela 2.
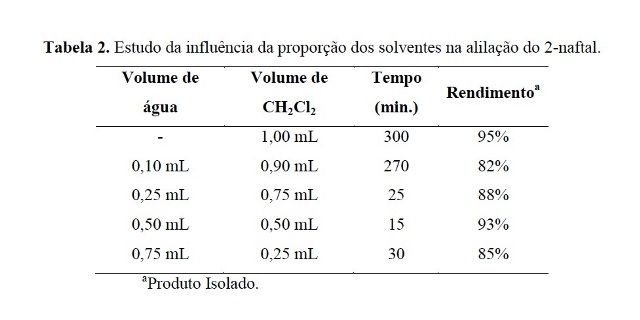
Estudo da influência da proporção dos solventes na
alilação do 2-naftal.
CONCLUSÕES: Foi desenvolvido um novo método para a alilação do 2-naftaldeído a partir do
aliltrifluoroborato de potássio catalisada pela Amberlyst A-15. A metodologia é
simples, rápida e eficiente; além disso, é ambientalmente amigável por empregar
água como um dos solventes. Novos estudos estão em andamento, visando à ampliação
os resultados para outros aldeídos e à exploração outras propriedades da A-15.
AGRADECIMENTOS: Os autores agradecem aos órgãos de fomento CNPq, CAPES, FACEPE e INCT-INAMI.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Nowrouzi, F.; Thadani, A. N.; Batey, R. A. Org. Lett. 2009, 11, 2631.
[2] Thadani, A. N.; Batey, R. A. Org.Lett. 2002, 4, 3827.
[3] Nowrouzi, F.; Thadani, A. N.; Batey, R. A. Org. Lett. 2009, 11, 2631-2634.
[4] de Fátima, A.; Robello, L. G.; Pilli, R. A. Quim. Nova 2006, 29, 1009.
[5] (a) Yamamoto, Y.; Asao, N. Chem. Rev. 1993, 93, 2207–2293; (b) Denmark, S. E.; Fu, J. Chem. Rev. 2003, 103, 2763.
[6] Thadani, A. N.; Batey, R. A. Org. Lett. 2002, 4, 3827.
