ÁREA: Alimentos
TÍTULO: Análise de carotenóides em raízes de genótipos de mandioca de mesa (Manihot esculenta Crantz) por cromatografia líquida de alta eficiência e quimiometria.
AUTORES: Moresco, R. (CCA/UFSC) ; da Costa Nunes, E. (CCA/UFSC/EPAGRI) ; Virgilio, U. (CCA/UFSC) ; Coelho, B. (CCA/UFSC) ; Maraschin, M. (CCA/UFSC) ; Kuhnen, S. (CCA/UFSC)
RESUMO: A mandioca é um alimento tradicional para muitas populações menos favorecidas e que geralmente também sofrem com a carência de vitamina A em sua dieta. Uma estratégia para abreviar esta deficiência está na identificação de genótipos com maior concentração de carotenóides em suas raízes. Neste estudo foram analisadas amostras de raízes de genótipos de mandioca por cromatografia líquida de alta eficiência e subsequente construção de modelo descritivo através de PCA, buscando a detecção de grupos genotípicos semelhantes. Foram identificados os carotenóides α, β-cis e β-trans caroteno, luteína, zeaxantina, β-criptoxantina e licopeno. O conjunto de dados gerados via CLAE, associadas à quimiometria, permitiu um melhor entendimento da variabilidade química das raízes dos genótipos estudados.
PALAVRAS CHAVES: carotenoides; Manihot esculenta Crantz; Quimiometria
INTRODUÇÃO: A mandioca (Manihot esculenta Crantz) é a terceira cultura mais importante, como fonte de calorias, superada pelo arroz e o milho (FAO, 2012). É consumida por populações de regiões onde prevalecem a seca, a pobreza, a desnutrição e a deficiência de vitamina A. Estima-se que 190 milhões de crianças em idade pré-escolar possuam baixa atividade de retinol no plasma, sintoma subclínico da deficiência de vitamina A (WHO, 2012). Na mandioca, o β-caroteno é o carotenoide majoritário com atividade provitamina A (RODRIGUEZ-AMAYA, 2008). Além deste, também são encontrados outros carotenóides como o licopeno e as xantofilas luteína, zeaxantina e criptoxantina de reconhecidos benefícios à saúde humana, atuando como agentes antioxidantes, redução do risco de degeneração macular associada à idade e à catarata, além de reduzir o risco de alguns tipos de cânceres (STAHL e SIES, 2003). No presente estudo, foram analisadas amostras de dez genótipos de mandioca de mesa, oriundas do Banco de Germoplasma do Programa de melhoramento genético de mandioca da Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina (EPAGRI), por cromatografia líquida de alta eficiência (CLAE), visando caracterizar o perfil carotenoídico destas. A matriz de dados quantitativos gerada foi utilizada à construção de modelo descritivo através do cálculo dos componentes principais (PCs), buscando a detecção de similaridade de grupos genotípicos quanto à variável em estudo. Assume-se que o desenvolvimento destas abordagens biotecnológicas (e.g. caracterização química), associadas a estes genótipos possam lhes agregar valor e uso como marcadores bioquímicos, subsidiando o programa de melhoramento genético da EPAGRI para seleção e identificação de genótipos promissores e/ou potenciais.
MATERIAL E MÉTODOS: Amostras de raízes de dez genótipos de mandioca de mesa (“Apronta mesa”, “Pioneira”, “Oriental”, “Amarela”, “Catarina”, “IAC 576-70”, “Salézio”, “Estação”, “Crioulo de Videira” e “Rosada”) foram obtidas junto ao BAG da Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina-EPAGRI. Os carotenóides foram extraídos conforme (RODRIGUEZ-AMAYA & KIMURA, 2004). Para as determinações por CLAE, a fração organossolvente foi evaporada em fluxo de nitrogênio e o extrato concentrado totalmente dissolvido em 1.0 ml de hexano. Alíquotas de 10 µl desta solução foram centrifugadas (5000rpm/10min), filtradas (0,22 um) e injetadas em cromatógrafo líquido (Shimadzu LC-10A), equipado com termostatizador (35ºC), coluna de fase reversa C18 (Vydac 201TP54, 250mm x 4.6mm, Ø 5μm) acoplada à pré-coluna (C18, Vydac 201TP54) e detector espectrofotométrico (450 ηm). A eluição utilizou metanol: acetonitrila (90: 10, v/v), fluxo de 1 mL/min e a identificação dos compostos de interesse foi efetuada por comparação dos tempos de retenção de amostras de compostos padrões puros, sob as mesmas condições experimentais. A quantificação dos carotenóides por CLAE foi realizada utilizando-se curva padrão externa (Sigma-Aldrich, MO-USA - β-caroteno y = 1,019x, r2 = 0,99; Luteína y = 7044,96x, r2 = 0,99; Licopeno y = 1019x, r2 = 0,99) considerando-se os valores de áreas dos picos de interesse para efeitos de cálculos das concentrações dos analitos. Os dados da quantificação cromatográfica foram submetidos à quimiometria, através da análise de componentes principais (PCA). A análise de dados utilizou os programas estatísticos GraphPad Prism 5, GraphPad Instat 3.06 e MVSP 3.1. Todos os procedimentos foram realizados em triplicata e protegidos da luz para evitar a foto-oxidação dos compostos.
RESULTADOS E DISCUSSÃO: Por CLAE identificaram-se os carotenóides β-cis e β-trans-caroteno (majoritário), α-caroteno, luteína, zeaxantina e β-criptoxantina em todos os genótipos. Licopeno ocorreu somente no genótipo “Rosada” (Figura 1). O β-caroteno possui atividade provitamina A. Luteína, zeaxantina e β-criptoxantina possuem ação antioxidante, além de importante papel na função imunológica (RODRIGUEZ-AMAYA, 2001). O α-caroteno tem ação antitumorogênica (DONALDSON, 2004; STAHL e SIES, 2003).O estudo quimiométrico (PCA) identificou padrões de similaridade agrupando-os em relação à composição carotenoídica, (Figura 2). Em seu conjunto PC1 e PC2 explicam 93,5 % da variância total dos dados da população amostral.As amostras agruparam-se em função da coloração da polpa das raízes e abundância relativa dos carotenóides em cada genótipo, a saber: genótipos com raízes de coloração amarela (agrupamento A, Fig. 2), em PC2 positivo, pelo maior teor de β-trans-caroteno, α-caroteno e luteína. Genótipos de coloração branca (agrupamento B, Fig. 2) em PC1 e PC2 negativo, por apresentarem teores inferiores destes, enquanto que as de coloração rosa apresentaram maior dissimilaridade, sendo agrupadas em PC1 positivo (agrupamento C, Fig. 2) devido aos maiores teores de licopeno, β-cis-caroteno, zeaxantina e β-criptoxantina. Segundo MEZETTI (2007), em programas de melhoramento genético exitosos na seleção de genótipos biofortificados de mandioca é necessária a caracterização (e.g. carotenoídica) dos genótipos parentais. Assim, a abordagem analítica utilizada, i.e., CLAE, associada à análise quimiométrica (PCA) apresenta-se como um instrumento eficiente para determinar a variabilidade química, auxiliando na seleção de genótipos de interesse.
Figura 1
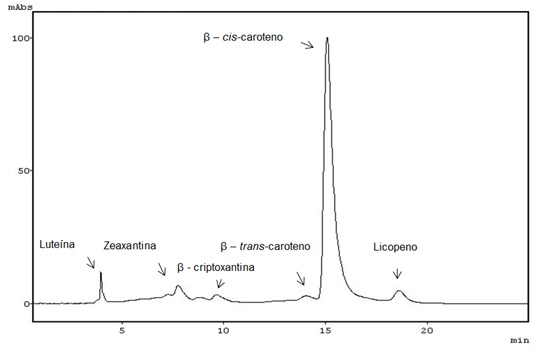
Perfil cromatográfico (CLAE), 450 nm de carotenóides de raízes do genótipo de mandioca de mesa “Rosada”.
Figura 2
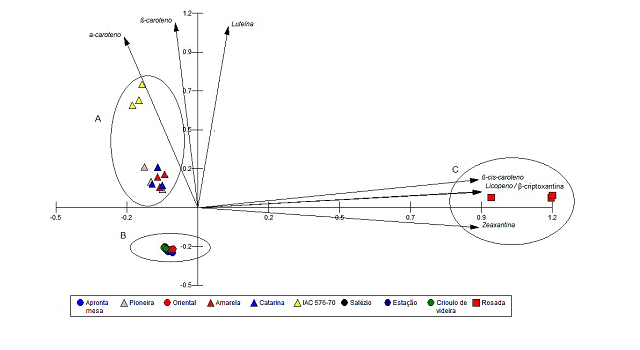
Distribuição fatorial dos PCs 1 e 2 resultante dos dados do perfil carotenoídico, determinado por CLAE, de raízes de 10 genótipos de M. esculenta.
CONCLUSÕES: O conjunto de dados obtidos por cromatografia líquida de alta eficiência (CLAE), acoplados à análise quimiométrica (PCA), permitiu constatar a variabilidade química existente associada à composição carotenoídica das raízes dos genótipos de mandioca de mesa (Manihot esculenta Crantz) estudados. Assume-se que estas tecnologias analíticas, são ferramentas eficientes de apoio a programas de melhoramento genético assistido à seleção de genótipos de mandioca de mesa com teores superiores de metabólitos-alvo, subsidiando a identificação de genótipos parentais promissores e/ou potenciais.
AGRADECIMENTOS: Ao CNPq e Capes pelo apoio financeiro. Edital 22/2010 – CNPq/Repensa. (Desenvolvimento da Cadeia Produtiva da Mandioca na Região Centro-Sul do Brasil).
REFERÊNCIAS BIBLIOGRÁFICA: DONALDSON, M.S. 2004. Nutrition and cancer: A review of the evidence for an anti-cancer diet. Nutr J, 5:3-19.
FAO. 2012 (Food and Agriculture Organization of the United Nations). Rome, Italy. Disponível em: http://www.fao.org/ag/agp/agpc/gcds/. Acesso em: 13/04/2012.
MEZETTE, T. F. 2007. Seleção de variedades de mandioca de mesa (Manihot esculenta Crantz) com altos teores de carotenóides e vitamina A. Dissertação (Mestrado em Genética, Melhoramento Vegetal e Biotecnologia), IAC (Instituto Agronômico de Campinas) São Paulo.
RODRIGUEZ-AMAYA, D. B. 2001. A guide to carotenoid analysis in food. OMNI Research, Washington, D. C. p. 64.
RODRIGUES-AMAYA, D. B. 2008. Fontes brasileiras de carotenóides: tabela brasileira de composição de carotenóides em alimentos. – Brasília: MMA, 100 p.
RODRIGUEZ-AMAYA D.B.; KIMURA M, 2004. HarvestPlus Handbook for Carotenoid Analysis. HarvestPlus Technical Monograph 2. HarvestPlus, Washington, DC, e Cali, International Food Policy Research Institute (IFPRI) and International Center for Tropical Agriculture (CIAT).
STAHL, W.; SIES, H. 2003. Antioxidant activity of carotenoids. Molecular Aspects of Medicine, 24: 345–351.
WHO. 2012. (World Health Organization Global) Prevalence of vitamin A deficiency in populations at risk 1995–2005. WHO Global Database on Vitamin A deficiency. Geneva.
