ÁREA: Alimentos
TÍTULO: AVALIAÇÃO DAS PROPRIEDADES MECÂNICAS E PERMEABILIDADE AO VAPOR DE ÁGUA EM FILMES BIOPOLIMÉRICOS DE GELATINA INCORPORANDO QUITOSANA
AUTORES: Pozzada dos Santos, J. (UNIVERSIDADE FEDERAL DO RIO GRANDE- FURG) ; Henrique Hoffmann, P. (UNIVERSIDADE FEDERAL DO RIO GRANDE- FURG) ; Fernandes Bandeira, S. (UNIVERSIDADE FEDERAL DO RIO GRANDE- FURG) ; Motta de Moura, C. (UNIVERSIDADE FEDERAL DO RIO GRANDE- FURG) ; Antonio de Almeida Pinto, L. (UNIVERSIDADE FEDERAL DO RIO GRANDE- FURG)
RESUMO: O objetivo do trabalho foi estudar o efeito da adição de quitosana em filmes
biopoliméricos de gelatina. A quitosana com massa molar de 150 kDa e grau de
desacetilação 86±1% e foi testada nas concentrações de 25 e 50%. A solução
filmogênica foi produzida a partir das etapas de dissolução, agitação mecânica e
secagem, o pH da solução foi ajustado à 3 e 4. O filme de gelatina com pH 4
apresentou uma resistência á tração cerca de 32% maior do que os com pH 3, já os
filmes onde adicionou-se quitosana apresentaram valores semelhantes em ambos os
pHs. Em relação ao alongamento os filmes com pH 3 e 4 não apresentaram diferença
significativa. A permeabilidade ao vapor de água mostrou diferença significativa
nos filmes com pH 3 e 4 entre os tipos de filmes sem e com adição de quitosana.
PALAVRAS CHAVES: biopolímero; propriedades mecânicas; permeab. ao vapor de água
INTRODUÇÃO: Proteínas, lipídios e polissacarídeos são os principais biopolímeros utilizados
para produzir filmes comestíveis. Embora estes filmes tenham reconhecidas
propriedades a serem aplicadas na área alimentícia como filmes de revestimento
comestíveis, eles também possuem alguns inconvenientes que restringem sua
utilização em condições específicas, devido à sua inerente sensibilidade à água,
baixa rigidez e resistência, especialmente em ambientes úmidos (DEBEAUFORT et
al., 1998). Uma das alternativas promissoras para melhorar as propriedades dos
filmes é através da combinação de biopolímeros. Vários tipos de filmes têm sido
desenvolvidos, combinando-se polissacarídeos e proteínas, e filmes produzidos a
partir de quitosana e gelatina têm mostrado ser homogêneos devido à
miscibilidade entre os dois biopolímeros. O uso adequado de embalagens
comestíveis depende fortemente de suas propriedades de barreira e mecânicas. A
perda destas características reduz sua eficácia (CHENG et al., 2003). A
quitosana é um polissacarídeo atóxico que possui diversas propriedades
biológicas, físico-químicas e antimicrobianas, obtida principalmente pela
desacetilação alcalina da quitina (NO et al., 2007). A gelatina é uma proteína
obtida pela hidrólise do colágeno derivado da pele, tecido conjuntivo branco, e
ossos de animais. Ela contém grupos carboxílicos na sua cadeia principal e tem o
potencial de se misturar com a quitosana, devido à sua capacidade de formar
ligações de hidrogênio com a quitosana (TARAVEL e DOMARD, 1993). Além disso, a
gelatina também é um polímero biodegradável, com muitas propriedades atrativas,
tais como excelente biocompatibilidde, plasticidade e aderência, sem antígenos,
e é amplamente utilizada na área da biomedicina e no campo de produtos
farmacêuticos (WEBB et al., 1998).
MATERIAL E MÉTODOS: A gelatina (GL) foi obtida de Vettec Brasil Ltda. (São Paulo, Brasil). A
quitosana (QT) foi obtida a partir de rejeitos de camarão (Penaeus
brasiliensis) através do
processo descrito por Moura et al. (2011), obtendo-se então a pasta de quitosana
com 150 kDa e 86±1,0% de massa molar e grau de desacetilação, respectivamente. A
pasta foi seca em leito de jorro conforme metodologia descrita por Dotto et al.
(2011). Foram preparados filmes a partir da combinação de GL/QT
(100:0/75:25/50:50). A solução filme formadora (SFF) de QT foi obtida através da
dissolução do pó de QT (1% p/p) em uma solução de ácido acético 1% (v/v). A SFF
de GL foi obtida através da dissolução do pó de GL (1% p/p) em água destilada.
Após as soluções serem misturadas estas permaneceram sob agitação mecânica por 4
min á 10000 rpm. O pH foi ajustado em 3,0 e 4,0 (pHmetro MB-10, Marte, BRA). Os
filmes foram obtidos por evaporação do solvente em estufa com circulação forçada
de ar a 40ºC por 24 h. Posteriormente, os filmes foram retirados das placas e
acondicionados em dessecadores mantidos a 25ºC e 75% de umidade relativa (UR),
durante pelo menos 48 h antes das análises. A umidade foi determinada pelo
método 934.06 da AOAC (1995). A espessura dos filmes foi obtida utilizando-se um
micrômetro digital (INSIZE IP54, Series 3103-25, BRA) resolução 0,001
mm/0,00005”. Testes de permeabilidade ao vapor de água (PVA) foram realizados
gravimetricamente a 25ºC, segundo o método E96/E96M-05 da ASTM (2001b). Para
determinação das propriedades mecânicas (resistência à tração - RT e alongamento
- A) utilizou-se um texturômetro (TA.XP2i, Stable Microsystems SMD, UK)
utilizando o método D882-02 da ASTM (2001a).
RESULTADOS E DISCUSSÃO: A Tabela 1 mostra os resultados dos biofilmes quanto à PVA, RT e A.
Filmes compostos de GL e QT foram obtidos e todos mostraram diferença
significativa entre si em relação a RT, porém o filme somente de GL no pH 4 foi
o que apresentou RT, em torno de 32% em relação ao filme no pH 3. A comparação
com os dados da literatura para ensaio de RT é difícil devido à composição CH
diferente, o método de solubilização e película de preparação (RIVERO et al.,
2009). Em relação à PVA no pH 3 o filme composto por GL/QT (50:50, 75:25)
apresentaram um valor cerca de 148% superior em relação ao filme de GL. Já em
relação ao pH 4 esse valor foi em torno de 43%. Toda a propriedade dessas
melhorias foram atribuídas às interações entre quitosana catiônica e a gelatina
aniônica, dando origem ao complexo eletrostática. Assim, para avaliar película
propriedades de barreira à base de gelatina ou de quitosana deve exigir que o
conhecimento da dependência de película de espessura de cada formulação
hidrocolóide particular. Quanto ao alongamento tanto os filmes em pH 3 quanto em
pH 4 não apresentaram diferença significativa entre si. Bourtoom e Chinnan,
(2008), relataram que a PVA dos filmes de mistura de carboidratos, entre estes a
quitosana, aumenta quando às proporções desta são maiores. Essa tendência foi
atribuída a maior hidrofilicidade (grupos NH3+) dos biofilmes com o
aumento do teor de quitosana. Segundo Debeaufort et al. (1998), um filme com
estrutura heterogênea apresenta descontinuidades na rede, que aumentam a
fragilidade do filme, devido a pontos preferenciais de quebra.
Tabela 1
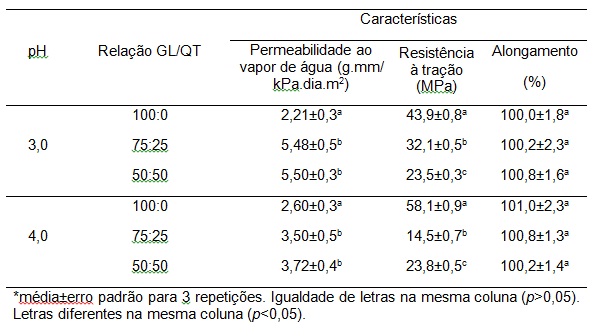
Características dos filmes biopoliméricos com
relação à permeabilidade ao vapor de água,
resistência à tração e alongamento.
CONCLUSÕES: O filme de GL com pH 4 apresentou uma RT cerca de 32% maior do que os com pH 3,
já
os filmes onde adicionou QT apresentaram valores semelhantes em ambos os pHs. Em
relação ao A os filmes com pH 3 e 4 não apresentaram diferença significativa
(p>0,05). A PVA mostrou diferença significativa nos filmes com pH 3 e 4 entre os
tipos de filmes sem e com adição de QT, porém o menor valor foi em pH 3 no filme
de GL (2,21 g.mm.kPa-1.dia-1.m-2).
AGRADECIMENTOS: Os autores agradecem a CAPES e a FURG.
REFERÊNCIAS BIBLIOGRÁFICA: AOAC. , Association of official analytical chemists. Official methods of analysis of AOAC international. 1995. 16th ed. Arlington.
ASTM. American Society for Testing and Materials. Standard test method for tensile properties of thin plastic sheeting. 2001a. Standard D882-02. In Annual book of ASTM. 162-170.
ASTM. American Society for Testing and Materials. Standard test methods for water vapor transmission of materials. 2001b. Standard Designations: E96/E96M-05. In Annual book of ASTM. 406-413.
BOURTOOM, T., CHINNAN, M. S. 2008. Preparation and properties of rice starch-chitosan blend biodegradable film. LWT-Food Science Technology. 41: 1633-1641.
CHENG, M., DENG, J., YANG, F., GONG, Y., ZHAO, N., & ZHANG, X. 2003. Study on physical properties and nerve cell affinity of composite films from chitosan and gelatin solutions. Biomaterials, 24: 2871–2880.
DEBEAUFORT, F., QUEZADA-GALO, J. A., & VOILLEY, A. 1998. Edible films and coatings: Tomorrow´ s packagings: A review. Critical Reviews in Food Science and Nutrition, 38: 299–313.
DOTTO, G. L., SOUZA, V. C., PINTO, L. A. A. 2011. Drying of chitosan in a spouted bed: The influences of temperature and equipment geometry in powder quality”. LWT – Food Science and Technology, 44: 1786-1792.
MOURA, C. M., MOURA, J. M., SOARES, N. M., PINTO, L. A. A. 2011. Evaluation of molar weight and deacetylation degree of chitosan during chitin deacetylation reaction: used to produce biofilm. Chemical Engineering and Processing, 50: 351-355.
NO, H. K., MEYERS, S. P., PRINYAWIWATKUI, W, XU, Z. 2007. Appllications of chitosan for improvement of quality and shelf life of foods: A review Journal of Food Science, 72: 87-100.
RIVERO, S., GARCÍA, M. A., PINOTTI, A. 2009. Composite and bi-layer films based on gelatin and chitosan. Journal Food Engineering, 90: 531-539.
TARAVEL, M. N., & DOMARD A. 1993. Relation between the physicochemical characteristics of collagen and its interaction with chitosan: I. Biomaterials; 14: 930–938.
WEBB, K., HLADY, V., TRESCO, P. A. 1998. Relative importance of surface wettability and charged functional groups on NIH 3T3 fibroblast attachment, spreading, and cytoskeletal organization. Journal Biomedical Material Research, 41: 422–30.
