ÁREA: Bioquímica e Biotecnologia
TÍTULO: Determinação da biointeração entre o peptídeo anticongelante Pa-MAP1 e membrana lipídica automontada
AUTORES: Nascimento, J.M. (UFPE) ; Oliveira, M.D.L. (UFPE) ; Franco, O.L. (UCB) ; Migliolo, L. (UCB) ; de Melo, C.P. (UFPE) ; Andrade, C.A.S. (UFPE)
RESUMO: Neste trabalho visamos decifrar o possível mecanismo de ação do peptídeo homólogo
Pa-MAP1 presente no peixe antártico Pleuronectes americanus, através
do estudo de modelos de membranas lipídicas por espectroscopia de impedância
elétrica (EIE). A adição de Pa-MAP1 resultou numa diminuição drástica da
resistência e numa mudança da heterogeneidade da membrana. Esses dados sugerem que
o mecanismo de ação segue o modelo carpete. Assim, o Pa-MAP1 tem um enorme
potencial de destruição da membrana, podendo ser utilizando como um novo agente
microbiano.
PALAVRAS CHAVES: peptídeo anticogelante; mecanismo de ação; antimicrobiano
INTRODUÇÃO: Nos últimos anos, vários estudos têm sido direcionados aos peptídeos
antimicrobianos (antimicrobial peptides – AMPs), os quais têm como alvo as
membranas microbianas. A ação dos AMPS é devida a estrutura catiônica anfipática
que possibilita a atração eletrostática por lipídios aniônicos presentes nos
microorganismos, seguida pela penetração na membrana, formando poros e levando a
morte celular (HALL et al., 2003). Outra classe de peptídeos multifuncionais
que tem sido estudada, porém com menor intensidade, são os peptídeos
anticongelantes (antifreeze peptides – AFPs). Estes são encontrados no sangue
e/ou nos tecidos de organismos que vivem em ambientes congelados, inibindo o
crescimento de cristais de gelo em seus fluidos. A família de AFPs tipo I tem
sido comumente caracterizada a partir do peixe Pleuronectes americanus. A
estrutura tridimensional deste peptídeo demonstra a semelhança com os AMPs,
consistindo de uma α-hélice rica em alanina composta por 11 aminoácidos com três
motivos de repetições imperfeitos (KUIPER et al., 2002). Estudos revelam que os
AFPs podem interagir com membranas biológicas, sendo esta interação dependente
da composição lipídica da membrana (TOMCZAK et al., 2002). Estas características
tornam-se importantes para o desenvolvimento de novas moléculas eficientes
contra uma ampla variedade de microorganismos patogênicos. Desta forma, este
trabalho tem por objetivo decifrar o possível mecanismo de ação de um peptídeo
análogo ao extraído do peixe antártico Pleuronectes americanus, chamado de Pa-
MAP1, através do estudo com modelos de membranas lipídicas por Espectroscopia de
Impedância Elétrica (EIE), monitorando a integridade da membrana em tempo real e
fornecendo importantes contribuições para os tipos de danos celulares induzidos
pelo AFP.
MATERIAL E MÉTODOS: As medidas de impedância elétricas foram realizadas em um analisador de
impedância 1260 (Solartron,UK), variando-se a frequência de 1Hz-1MHz. Foram
utilizados diferentes potenciais (0V, 0.5V e 1V) e uma amplitude de 100mV. Para
a determinação das partes real e imaginária da impedância foi utilizado um
sistema de placas paralelas, composto por duas placas de aço inoxidável com
dimensões de 64 mm x 21 mm dispostas paralelamente a uma distância de 10 mm, as
quais serviram como eletrodos. A limpeza do eletrodo foi realizada,
sequencialmente, em clorofórmio e água deionizada imersos em banho ultrassônico.
A formação das membranas de lipídica foi feita por auto-montagem com o
fosfolipídio 1,2-dipalmitoil-sn-glicero-3-fosfatidilcolina (DPPC) pelo método de
“dipping coating”. O sistema foi imerso em um béquer contendo 5 mL da solução de
interesse para a realização das leituras. Inicialmente, o eletrodo foi imerso em
uma solução de DPPC (1 mg/mL), onde foram realizadas medidas em um intervalo de
tempo de 5 minutos. Após chegar ao tempo máximo da deposição (30 minutos), o
eletrodo com a membrana foi transferido para um béquer contendo 5 mL da solução
de AFP (0.1 mg/mL), onde foram realizadas medidas elétricas também a cada
intervalo de 5 minutos. Antes da deposição da membrana lipídica foi realizada
uma medida do eletrodo limpo (sem modificações) em água deionizada, a qual
serviu como padrão para quantificar cada etapa de modificação. Todas as etapas
de experimentação foram realizadas em triplicata à temperatura ambiente. As
imagens de microscopia eletrônica de varredura (MEV) foram obtidas a partir de
um microscópio JSM 5900 (JEOL Instruments, Japão) a uma voltagem de aceleração
de 5 kV e uma distância de trabalho de 5 µM.
RESULTADOS E DISCUSSÃO: Dentre os mecanismos propostos para descrever os modos de ação dos AMPs, quatro
modelos clássicos merecem destaque: os modelos barril, poro toroidal, carpete e
detergente (HALL et al., 2003). A Figura 1a mostra a curva da resistência da
membrana (Rm) versus o tempo de ação do Pa-MAP1. A adição de Pa-MAP1
resultou numa diminuição drástica da resistência da membrana no primeiro minuto
de exposição, mantendo-se constante até o final do tempo de permanência (~50
minutos). Além disso, é possível observar que não houve variação aparente em
relação à resistência da membrana na resposta impedimétrica sob os diferentes
potenciais aplicados. Por outro lado, a ação do Pa-MAP1 induz a heterogeneidade
da membrana com os valores de n apresentando mínimos entre 0,67 a 0,79
durante o período de exposição, onde os valores mais positivos causam uma maior
alteração na homogeneidade da membrana (Fig. 1b). De acordo com o modelo
carpete, os peptídeos se agregam após a ligação à bicamada, diminuindo assim a
homogeneidade e resistência da membrana (CHANG et al., 2008). A recuperação na
homogeneidade da membrana observada nos nossos experimentos pode ser explicada
pela formação de “pequenos tapetes” dentro do primeiro minuto em alguns locais
da membrana, causando a desestabilização, seguida pela redistribuição lateral de
lipídios/peptídeos, uma vez que a membrana como um todo permanece intacta e
ainda exibe uma resistência mensurável (CHANG et al., 2008). A superfície da
membrana antes e após a exposição a Pa-MAP1 foi observada através de MEV (Fig.
2). A camada de lipídio aparece como uma superfície plana e lisa (Fig. 2a). Após
a exposição a Pa-MAP1 a membrana tornou-se bastante heterogênea, aparentando a
formação de um “carpete” com algumas falhas (Fig. 2b).
Figura 1
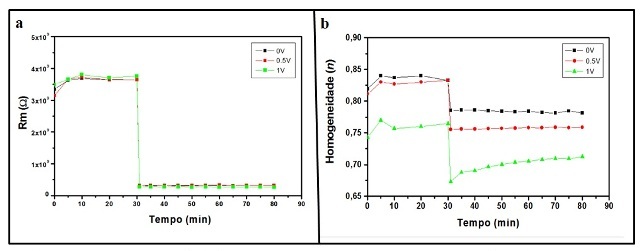
Resistência – Rm (a) e homogeneidade – n (b) da
membrana em função do tempo sob diferentes
potenciais. O Pa-MAP1 foi adicionado no 30º minuto.
Figura 2

Microfotografias da camada de DPPC antes (a) e após
(b) a exposição de Pa-MAP1.
CONCLUSÕES: Através dos resultados obtidos podemos concluir que o peptídeo Pa-MAP1 possui um
grande potencial em desestabilizar membranas, o que pode explicar sua atividade
antimicrobiana observada in vitro. As respostas obtidas através de EIE
sugere que mecanismo de ação de Pa-MAP1 segue o modelo carpete, tendo a
desestabilização ocorrida no primeiro minuto de exposição ao peptídeo. Em adição,
a destruição da membrana ocorre localmente, podendo ser reparada por
redistribuição dos lipídios/peptídeos. Os dados obtidos indicam que Pa-MAP1 pode
ser utilizado como um novo agente antimicrobiano.
AGRADECIMENTOS: Os autores agradecem à Rede Nanobiotecnologia/CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: CHANG, W.K.; WIMLEY, W.C.; SEARSON, P.C.; HRISTOVA, K.; MERZLYAKOV, M. 2008. Characterization of antimicrobial peptide activity by electrochemical impedance spectroscopy. Biochimica et Biophysica Acta-Biomembranes, 1778(10):2430-2436.
HALL, K.; MOZSOLITS, H.; AGUILAR, M. I. 2003. Surface plasmon resonance analysis of antimicrobial peptide-membrane interactions: affinity & mechanism of action. Letters in Peptide Science, 10(5-6): 475-485.
KUIPER, M.J.; FECONDO, J.V.; WONG, M.G. 2002. Rational design of alpha-helical antifreeze peptides. Journal Peptide Research, 59: 1-8.
TOMCZAK, M.M.; HINCHA, D.K.; ESTRADA, S.D.; WOLKERS, W.F.; CROWE, L.M.; FEENEY, R.E.; TABLIN, F.; CROWE, J.H. 2002. A mechanism for stabilization of membranes at low temperatures by an antifreeze protein. Biophysical Journal, 82: 874-881.
