ÁREA: Bioquímica e Biotecnologia
TÍTULO: DESENVOLVIMENTO DE SENSORES IMPRESSOS NANOESTRUTURADOS PARA DETECÇÃO ELETROQUÍMICA DA TROPONINA T CARDÍACA HUMANA
AUTORES: Silva, B.V.M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Cavalcanti, I.T. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, M.M.S. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Freitas, T.A. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Mattos, A.B. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Dutra, R.F. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
RESUMO: As troponinas cardíacas são proteínas estruturais do complexo contrátil do
miocárdio, consideradas atualmente como moléculas padrão-ouro no diagnóstico do
infarto. Neste trabalho, sensores impressos portáteis e descartáveis foram
desenvolvidos para detecção eletroquímica da troponina T cardíaca humana através
da interação antígeno-anticorpo. Nanotubos de carbono forma utilizados para
modificação da matriz impressa, com o objetivo de explorar suas propriedades
eletrocatalíticas e otimizar a sensibilidade e reprodutibilidade da plataforma
sensora. A curva de calibração do imunossensor proposto apresentou uma boa
linearidade (r = 0,992; p<0,0001; n=7) e limite de detecção (0,0035 ng/mL) dentro
dos padrões clínicos de estratificação do dano cardíaco.
PALAVRAS CHAVES: eletrodos impressos; nanotubos de carbono; troponinas cardíacas
INTRODUÇÃO: Os marcadores cardíacos, em especial as troponinas cardíacas, são componentes
essenciais utilizados para o diagnóstico do infarto, devido a sua alta
sensibilidade e especificidade. Atualmente, diversos imunoensaios têm sido
empregados na rotina laboratorial para dosagem das troponinas cardíacas (ALPERT
et al., 2000; CHRISTENSON & AZZAZY, 2009). Entretanto estes apresentam
significativas limitações para diagnóstico à beira do leito de pacientes
infartados de modo prático, rápido e seguro. No intuito de desenvolver novas
tecnologias para diagnóstico do infarto agudo do miocárdio, os imunossensores
eletroquímicos na configuração de eletrodos impressos (EIs) surgem como
importantes ferramentas analíticas, devido a sua alta sensibilidade, baixo
custo, compatibilidade com as tecnologias de miniaturização de sensores e
capacidade de produção em massa (METTERS, KADARA & BANKS, 2011). Considerando a
imobilização como uma das etapas fundamentais no desenvolvimento de
imunossensores, a introdução de nanomateriais que permitam aumentar a área
eletroativa e a eficiência da imobilização, resultando numa maior sensibilidade
destes dispositivos, tem sido realizada (HU & LI, 2011). Dentre os vários tipos
de nanomateriais, os nanotubos de carbono (NTCs) têm recebido especial atenção
devido as suas propriedades eletrocatalíticas, excelente condutividade elétrica
e versatilidade para funcionalização com diferentes grupos proteína-reativo, que
os tornam potencialmente úteis para aplicação em sensores eletroquímicos (YANG
et al., 2010; SCIDA et al., 2011). Este trabalho tem como objetivo desenvolver
um imunossensor eletroquímico empregando EI modificado com NTCs amino-
funcionalizados (NTCs-NH2) para determinação da troponina T cardíaca humana
(cTnT).
MATERIAL E MÉTODOS: O EI foi confeccionado através da impressão de um fino filme de tinta de carbono
modificado com NTCs-NH2 sobre a superfície moldada do politereftalato de etila.
Previamente a construção do protótipo sensor, os NTCs-NH2 foram dispersos no
solvente orgânico dimetilformamida. Após o processo de confecção, o EI foi
submetido a uma limpeza eletroquímico em KCl (0,1 M) durante 40 voltametrias
cíclicas na faixa de potencial de -2 a 2 V, a velocidade de varredura de 100
mV/s (ALONSO-LOMILLO et al., 2011). Para imobilização da biomolécula a
superfície sensora do EI, os grupamentos carboxílicos terminais dos anticorpos
anti-cTnT foram ativados com uma solução de EDC (0,002 M) e NHS (0,005 M)
preparada em tampão PBS (0,01 M; pH 7,4). Uma alíquota de 10 μL da solução de
anti-cTnT ativado foi pipetada sobre a superfície do EI e mantida durante 60 min
em câmera úmida à temperatura ambiente. Posteriormente, os sítios livres não
específicos na interface sensora foram bloqueados com uma solução de glicina
(0,05 M). Os ensaios eletroquímicos foram realizados usando um sistema tri-
eletródico, que consistiu em um eletrodo de trabalho impresso (Ø= 4 mm), um
eletrodo auxiliar de platina e um eletrodo de Ag/AgCl (KCl Sat.) como
referência, acoplados a um potenciostato modelo PGSTAT 12 da marca AUTOLAB
(Metrohm Pensalab, Brasil) e controlado pelo software GPES 4.9 (Eco Chemie BV,
Holanda). Todas as medidas foram realizadas em K3[Fe(CN)6]/K4[Fe(CN)6] (0,005 M)
preparado em tampão PBS (0,01 M, pH 7,4). As técnicas de voltametria cíclica e
de pulso diferencial foram utilizadas, respectivamente, para caracterização da
interface sensora e detecção eletroquímica da cTnT.
RESULTADOS E DISCUSSÃO: Os grupos funcionais dos NTCs na interface da plataforma sensora foram
estrategicamente empregados neste trabalho para imobilização dos anticorpos
anti-cTnT. Os voltamogramas cíclicos na Figura 1 representam o perfil
eletroquímico das etapas de construção do imunossensor. O EI como manufaturado
exibiu uma separação de potencial de pico (ΔEp) de aproximadamente 0,68 V (curva
I). Entretanto, após o condicionamento da superfície do sensor através do
tratamento eletroquímico em KCl (0,1 M), observou-se um decréscimo do ΔEp para
0,38 V, indicando a remoção dos contaminantes orgânicos e impurezas na
superfície (curva II). Quando o anti-cTnT foi imobilizado, o imunossensor
apresentou uma diminuição da corrente farádica, resultado da redução da
transferência de elétrons na interface da plataforma sensora (curva III). Após o
bloqueio dos sítios ligantes não específicos com glicina, o mesmo comportamento
anterior foi observado (curva IV). Análises por voltametria de pulso diferencial
foram empregadas para detecção direta da cTnT e obtenção de uma curva de
calibração do imunossensor. Para tais ensaios, o EI foi incubado com diferentes
concentrações de cTnT e submetido a medidas voltamétricas em
K3[Fe(CN)6]/K4[Fe(CN)6] (0.005 M) preparado em tampão PBS (0,005 M; pH 6,5). Os
resultados obtidos na Figura 2 demonstram uma relação proporcional indireta
entre os picos de corrente dos voltamogramas de pulso diferencial e as
concentrações de cTnT. A curva de calibração do EI apresentou um coeficiente de
correlação de 0,992 (p<0,001, n= 7), combinado a um baixo erro relativo (<<1%) e
um baixo limite de detecção (0,0035 ng/mL). Esses resultados evidenciam a
potencialidade do EI desenvolvido para uma futura aplicação como teste de pronto
atendimento em emergências cardiológicas.
Figura 1.
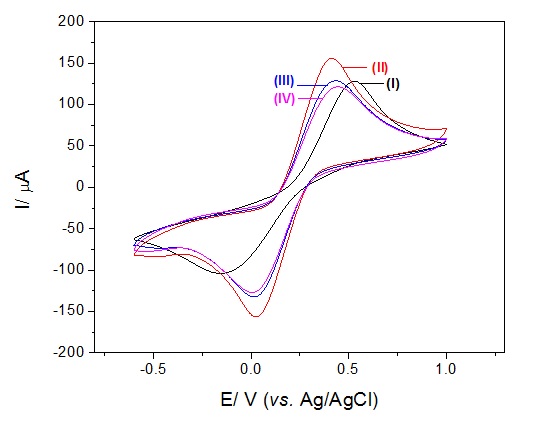
Voltamogramas cíclicos das etapas de construção do
imunossensor.
Figura 2
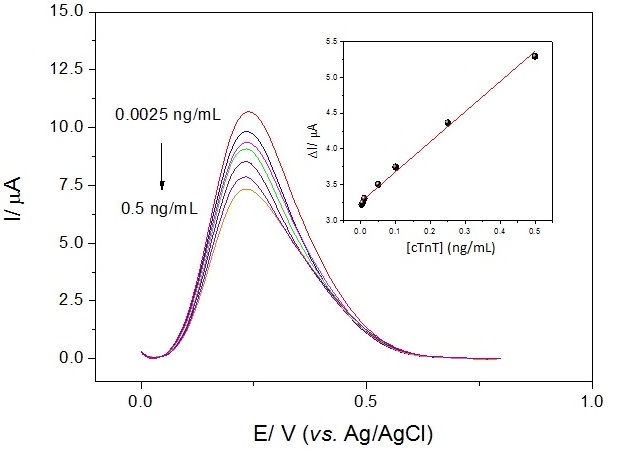
Curva de calibração do imunossensor.
CONCLUSÕES: A modificação do filme de carbono impresso com NTCs-NH2 contribuiu para o
desenvolvimento de sensores mais simples e rápidos, dispensando o uso de polímeros
e reagentes de ligação cruzada para funcionalização da interface sensora. Como
perspectivas futuras deste trabalho, tem-se a realização de alguns estudos
complementares, como testes com amostras de soro e sangue total.
AGRADECIMENTOS: Capes, UFPE e CETENE-PE.
REFERÊNCIAS BIBLIOGRÁFICA: ALONSO-LOMILLO, M.A.; DOMÍNGUEZ-RENEDO, O.; ROMÁN, L.D.T.D.; ARCOS-MARTÍNEZ, M.J. 2011. Horseradish peroxidase-screen printed biosensors for determination of Ochratoxin A. Analytical Chimica Acta, 688: 49-53.
ALPERT, J.S.; THYGESEN, K.; ANTMAN, E.; BASSAND, J.P. 2010. Myocardial infarction redefined-a consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. Journal of the American College of Cardiology, 36: 959-969.
CHRISTENSON, R.H.; AZZAZY, H.M. 2009. Cardiac point of care testing: a focused review of current National Academy of Clinical Biochemistry guidelines and measurement platforms. Clinical Biochemistry, 42:150-157.
HU, W.; LI, C.M. 2011. Nanomaterial-based advanced immunoassays. Nanomedicine and Nanobiotechnology, 3: 119–133.
METTERS, J.P.; KADARA, R.O.; BANKS, C.E. 2011. New directions in screen printed electroanalytical sensors: an overview of recent developments. Analyst, 136: 1067-76.
SCIDA, K.; STEGE, P.W.; HABY, G.; MESSINA, G.A.; GARCIA, C.D. 2011. Recent applications of carbon-based nanomaterials in analytical chemistry: critical review. Analytica Chimica Acta, 691: 6-17.
YANG, W.; RATINAC, K.R.; RINGER, S.P.; THORDARSON, P.; GOODING, J.J.; BRAET, F. 2010. Carbon Nanomaterials in Biosensors: Should You Use Nanotubes or Graphene? Angewandte Chemie International Edition, 49: 2114–2138.
