ÁREA: Bioquímica e Biotecnologia
TÍTULO: PRODUÇÃO DE METABÓLITOS BIOATIVOS DE Streptomyces sp. C1.129 ISOLADO DA RIZOSFERA DE Caesalpinea pyramidalis TUL.
AUTORES: Silva, G.R. (UFPE) ; Melo, J.G.S. (UFPE) ; Sena, K.X.F.R. (UFPE) ; Melo, I.S. (EMBRAPA) ; Lima, G.M.S. (UFPE) ; Araújo, J.M. (UFPE)
RESUMO: O objetivo desta pesquisa foi selecionar o melhor meio de cultura e tempo de produção de metabólitos bioativos através da fermentação de Streptomyces sp. C1.129 isolado da rizosfera de C. pyramidalis TUL. do bioma Caatinga. A fermentação foi realizada em diferentes condições nutricionais, em 4 meios de cultura com diferentes fontes de carbono, nitrogênio e sais minerais: meios M1 e MPE - glicose e farinha de soja, meio AYm - glicose, glicerol, L-arginina e extrato de levedura e meio ISP-4 - amido e (NH4)2SO4. Avaliou-se a atividade antimicrobiana, pH e produção de biomassa a cada 24 h por 120 horas. O meio M1 em pH 7,0 com 72 horas de fermentação mostrou melhor resultado para a produção de substâncias bioativas frente a bactérias Gram-positivas, com halos de inibição de 28 mm de diâmetro.
PALAVRAS CHAVES: Streptomyces sp; Caesalpinia pyramidalis T; fermentação
INTRODUÇÃO: Alguns produtos do metabolismo secundário, como os antibióticos, são capazes de
inibir o desenvolvimento de outros micro-organismos em pequenas concentrações
(LIMA et al, 2001). Bactérias pertencentes ao filo das Actinobactérias ocorrem
nos mais diversos ambientes como sedimentos oceânicos, plantas, gelo, associados com liquens, sendo observado maior ocorrência no solo (MINCER et al, 2010; VASCONCELLOS et al, 2010). Muitos estudos comprovam a atividade antibacteriana de Streptomyces frente a bactérias Gram-positivas e Gram-negativas (THAKUR et al, 2007) e até mesmo frente a cepas de Staphylococcus aureus meticilina resistentes (HIGGINBOTHAM e MURPHY, 2010). Streptomyces são os principais produtores de inúmeros antibacterianos como eritromicina, estreptomicinas, kanamicina, novobiocina, vancomicina, e até mesmo antifúngicos, como nistatina (LACAZ, 1965). O surgimento rápido e agressivo de bactérias patogênicas resistentes a agentes antimicrobianos vem motivando os cientistas, a buscar novas biomoléculas, destacando-se pesquisas com actinobactérias isoladas da rizosfera representando uma fonte promissora de novos antibióticos de grande interesse para a indústria farmacêutica e biotecnológica. Esta pesquisa teve como objetivo selecionar as melhores condições de fermentação para de metabólitos bioativos pelo Streptomyces SP. C1.129.
MATERIAL E MÉTODOS: Foram utilizados os meios de cultura líquidos ISP-4, contendo amido solúvel 2% e (NH4)2SO4 4% (SHIRLING e GOTTLIEB, 1966), AY modificado - Glicose 0,1%, Glicerol 0,1%, L-arginina 0,03%, Ext. de levedura 0,1% (NONOMURA e OHARA, 1969a), enquanto que M1 e MPE eram constituídos respectivamente por glicose 1% e 2% e farinha de soja 1% e 2% (KAWAMURA, 1976), além de sais minerais em todos os meio líquidos utilizados. Os cultivos foram realizados sob agitação de 180 rpm por 48 horas a 30º C. Em seguida, 10 % do pré-inóculo foi transferido para Erlenmeyers de 250 mL contendo 100 mL dos mesmos meios de cultura e cultivadas nas mesmas condições durante 120 horas. A cada 24 horas alíquotas do fermentado foram centrifugadas, verificando-se pH, produção de biomassa e atividade antimicrobiana que foi determinada através da técnica de difusão em disco (KIRBY et al, 1966), utilizando os seguintes micro-organismos: Fusarium moniliforme (UFPEDA-2456); Malassezia furfur UFPEDA-1320; Candida albicans NCF-USA, Bacillus subtilis (ATCC 6633); Staphylococcus aureus (ATCC 6538); Staphylococcus aureus Meticilina Resistente: UFPEDA-700; Escherichia coli (ATCC 25922); Klebsiella pneumoniae (ATCC 29665) e Pseudomonas aeruginosa (ATCC 27853). Foram considerados os valores médios de três repetições.
RESULTADOS E DISCUSSÃO: Os resultados da atividade antimicrobiana utilizando diferentes meios de cultura podem ser observados no Gráfico 1, onde foram considerados os halos de inibição superior a 15 mm para S. aureus ATCC 6538, MRSA UFPEDA-700 e B. subtilis ATCC 6633. O meio M1, pH 7, mostrou maior produção do metabólito bioativo com 72 horas de fermentação, apresentando atividade antimicrobiana frente aos micro-organismos testados. Thakur et al., 2007, que avaliaram a atividade antimicrobiana de Streptomyces em solos da Índia observaram também elevada inibição contra bactérias Gram-positivas. Esta maior ocorrência de antibióticos contra bactérias Gram-positivas está relacionada com a composição da parede celular destas bactérias, que são mais simples que a das Gram-negativas. A massa celular formada e os valores de pH ao longo da fermentação estão apresentados no Gráfico 2, onde pode ser observado oscilação de pH entre 5 e 8. Parâmetros envolvidos no processo de fermentação tais como pH, temperatura, composição nutricional do meio e o tempo de fermentação, se alterados podem modificar a quantidade de metabólitos secundários produzidos pela linhagem em estudo (PFEFFERLE et al., 2000).
Gráfico 1
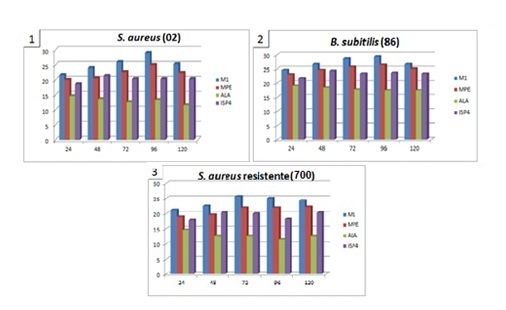
Halos de inibição nos diferentes meios (mm) e Tempo
de crescimento (horas), frente a S. aureus (1), B.
subtilis (2) e MRSA (3).
Gráfico 2
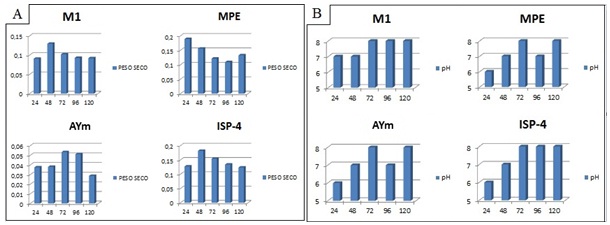
A) Determinação da biomassa de Streptomyces sp.(g/mL); B) Avaliação do pH do processo fermentativo, ao longo de 120 horas de fermentação.
CONCLUSÕES: Neste trabalho foi observado que o Streptomyces sp. C1.129 isolado da rizosfera de Caesalpinia pyramidalis TUL. apresentou melhor atividade antimicrobiana com 72 horas de fermentação no meio M1, pH 7,0 para bactérias Gram-positivas, inclusive cepas patogênicas. Estes resultados indicam o potencial desta linhagem de Streptomyces sp. C1.129 como produtora de antibióticos com espectro de ação para S. aureus multirresistentes.
AGRADECIMENTOS: À FACEPE pela bolsa de mestrado concedida.
REFERÊNCIAS BIBLIOGRÁFICA: 1.HIGGINBOTHAM, S. J.; MURPHY, C. D. Identification and characterization of a Streptomyces sp. Isolate exhibiting activity against methicillin-resistant Staphylococcus aureus. Microbiological Research, v. 165, p. 82-86, 2010.
2.KAWAMURA, T.; TAGO, K.; BEPPEU, T.; ARIMA, K. Antiviral Antibiotic 515-1. Taxonomy of the producing atrain and study conditions for production of the antibiotic. The journal of antibiotics. Tokio, v. 29, n. 3, p. 242-247, 1976.
3.KIRBY, W. M. M.; BAUER, A. W.; SHERRIS, J. C.; TURK, M. Antibiotics susceptibility test by a standardized single disk method. Amer. J. Clin. Pathol, v. 45, p. 493-496, 1966.
4.LACAZ, C. S. Antibióticos. São Paulo: Fundo editorial Procienx, p. 16-60, 1965.
5.LIMA, U. A.; AQUARONE, E.; BORZANI, W.; SCHMIDELL, W. Biotecnologia Industrial: Processos Fermentativos e Enzimáticos. São Paulo: Edgard Blücher, v. 3, 2001. 593 p.
6.MINCER, T. J.; JENSEN, P. R.; KAUFFMAN, C. A.; FENICAL, W. Widespread and Persistent Populations of a Major New Marine Actinomycete Taxon in Ocean Sediments. Applied and Environmental Microbiology, v. 68, n. 10, p. 5005–5011, 2002.
7.NOMOMURA, H.; OHARA, Y. Distribution of actinomycetes in soil. VI. A culture method effective for both preferencial isolation and enumeration of Microbiospora and Streptosporangium strains in soil. (Part 1). J. Ferment. Technol, v. 47, p. 463-469. 1969a.
8.PFEFFERLE, C.; HEOBALD, U.; GÜRTLER, H.; FIEDLER, H.P. 2000. Improved secondary metabolite production in the genus Streptosporangium by optimization of the fermentation conditions. J. Biotechnol., v. 80, p. 135-142.
9.SHIRLING, E. B.; E GOTTLIEB, D. Methods for characterization of Streptomyces species. Intern. J. Syst. Bacteriol, v. 16, p. 313-340, 1966.
10.THAKUR, D.; YADAV, A.; GOGOI, B. K.; BORA, T.C. Isolation and screening of Streptomyces in soil of protected forest areas from the states of Assam and Tripura, India, for antimicrobial metabolites. Journal de Mycologie Médicale, v. 17, p. 242-249, 2007.
11.VASCONCELLOS, R. L. F.; SILVA, M. C. P.; RIBEIRO, C. M.; NOGUEIRA CARDOSO, E. J. B. N. Isolation and screening for plant growth-promoting (PGP) actinobacteria from Araucaria angustifolia rhizosphere soil. Sci. Agric., v. 67, n. 6, p. 743-746, 2010.
