ÁREA: Bioquímica e Biotecnologia
TÍTULO: DESENVOLVIMENTO DE BIOSSENSOR BASEADO EM FIBRAS DE CARBONO PARA DETECÇÃO DA TOXINA RICINA EM TORTA DE MAMONA
AUTORES: Freitas, T.A. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Mattos, A.B. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Silva, B.V.M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Lima, R.M.M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Dutra, R.F. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
RESUMO: A lectina ricina é a principal responsável pela toxicidade da torta de mamona. O
desenvolvimento de biossensores para detecção da ricina apresenta vantagens
quanto
ao custo e tempo de execução. Biossensores são dispositivos eletrônicos que
possuem um elemento biológico fixado numa superfície sensora acoplada a um
transdutor. Dentre os materiais utilizados em biossensores estão as fibras de
carbono (FC), devido às suas inúmeras vantagens, destacando-se: baixa densidade
associada à alta resistência mecânica, boa condutividade e baixo custo. O
objetivo
do trabalho foi desenvolver um biossensor utilizando eletrodos de FC, para
detecção da ricina na torta de mamona. O sistema proposto apresentou boa
reprodutibilidade, estabilidade e linearidade com r=0,99875 (p<0,0001, n=5).
PALAVRAS CHAVES: ricina; biossensor; fibras de carbono
INTRODUÇÃO: O crescimento da produção de mamona no Brasil e a expectativa de plantio de
grandes áreas com objetivo de produção de biocombustíveis atraiu atenção sobre a
torta de mamona, um importante co-produto dessa cadeia produtiva (AZEVEDO &
LIMA, 2001). A torta de mamona tem sido aproveitada como fertilizante, embora
possa obter valor maior quando utilizada como alimento animal, devido ao seu
alto teor protéico (BELTRÃO, 2005). No entanto, para ser usada como alimento,
precisa passar por um processo de detoxificação, devido à presença de agentes
tóxicos em sua composição (RIBEIRO & ÁVILA-FILHO, 2006). A lectina ricina é a
principal responsável pela toxicidade da torta de mamona (SPIVAK & HENDRICKSON,
2005). Métodos para medição de ricina são essenciais para que se possa trabalhar
com essa toxina tanto em pesquisa quanto em processamento industrial. Todos os
processos analíticos de determinação desta lectina são sensíveis, porém envolvem
metodologias complicadas e equipamentos caros, implicam em diversas etapas
bioquímicas, requerem pessoal especializado, são testes demorados, além de serem
de custo elevado considerando a relação custo versus benefício (FELTIS et al.,
2008). O desenvolvimento de biossensores para detecção da ricina apresenta
vantagens quanto ao custo e tempo de execução (RASOOLY & JACOBSON, 2006;
VADDIRAJU et al., 2009). A utilização de FC como material eletródico surge como
alternativa promissora no desenvolvimento de biossensores para a detecção de
lectinas. A especificidade das lectinas com relação a carboidratos possibilita
sua aplicação nas áreas biológicas e agronômicas (WU et al., 2006). O objetivo
do trabalho foi desenvolver um biossensor com transdução eletroquímica,
utilizando eletrodos de FC, para detecção da ricina na torta de mamona.
MATERIAL E MÉTODOS: Foi empregada uma célula eletroquímica convencional tri-eletródica (composta por
um eletrodo de trabalho de FC; um eletrodo auxiliar de platina e um eletrodo de
referência de Ag/AgCl) acoplada a um potenciostato modelo PGSTAT 12 da marca
AUTOLAB (Metrohm Pensalab, Brasil), acoplado a um microcomputador e controlado
pelo software GPES 4.9 (Eco Chemie BV, Holanda). As análises dos ensaios foram
realizadas através da técnica de voltametria cíclica. As FC foram primeiramente
modificadas por um filme polissacarídico de xiloglucana, pois possui em sua
estrutura química resíduos de galactose, os quais são específicos e podem
interagir com a (cadeia B) RTB da lectina ricina. Após incorporação da
xiloglucana nas fibras, uma alíquota (35μL) da solução de ricina foi incubada na
superfície do eletrodo. Efeitos quanto ao pH, natureza, concentração do
eletrólito, tempo de interação lectina-carboidrato, reprodutibilidade e
repetibilidade foram realizados.
RESULTADOS E DISCUSSÃO: Ensaios para a otimização das condições experimentais foram realizados. A
influência do pH na resposta voltamétrica do eletrodo proposto foi examinada na
faixa entre 5,5 e 8,0. Observou-se um aumento da corrente de pico catódica com o
aumento do pH até adquirir um valor máximo em pH 6,0. Então, o pH 6,0 foi
adotado para os estudos posteriores. O desempenho do biossensor depende não só
do pH, mas também da natureza do eletrólito suporte, bem como de sua
concentração, podendo mudar sua estabilidade. Quatro tipos de soluções tampão
foram avaliadas: PBS, HEPES, PIPES e TRIS. De acordo com a amplitude da
corrente, o tampão PBS apresentou a melhor resposta eletroquímica. A
concentração da solução eletrólica pode influenciar na resposta do eletrodo
proposto. Desta forma, para a escolha da melhor concentração foram feitas
medidas em tampão PBS, pH 6,0, nas molaridades 0,1; 0,5; 1,0; 2,5; 5,0 e 10 mMol
L-1. A melhor resposta do eletrodo ocorreu até um plateau ser alcançado em 2,5
mMol L-1. O tempo de interação lectina-carbiodrato foi estudado e foi observado
que o tempo de 25 minutos foi o suficiente para total interação da lectina
ricina com os resíduos de galactose presentes na estrutura da xiloglucana. A
reprodutibilidade do biossensor proposto foi investigada entre 10 eletrodos
idênticos e apresentou boa reprodutibilidade com desvio padrão de 2,52%. Também
se apresentou estável durante 25 ciclos de varredura contínuos, com baixo desvio
padrão (0,3%) entre os ciclos. Após estabelecidas as condições experimentais, a
reta de calibração da ricina foi adquirida, demonstrando boa linearidade com
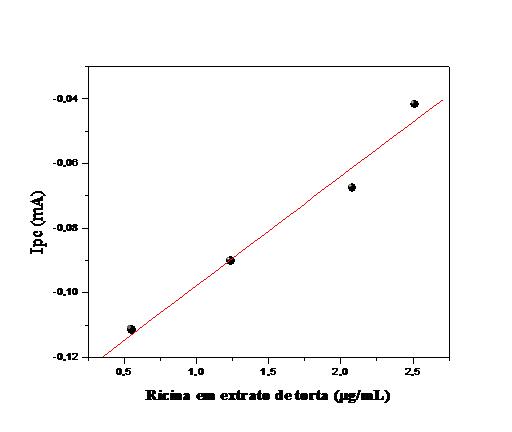
r=0,99875 (p<0,0001, n=5) (Figura 1). A curva de calibração da amostra real de
torta de mamona foi levantada e o LD=1,201 µg/mL-1 e sensibilidade de 0,035
mA.μg/mL-1 (Figura 2).
Figura 1
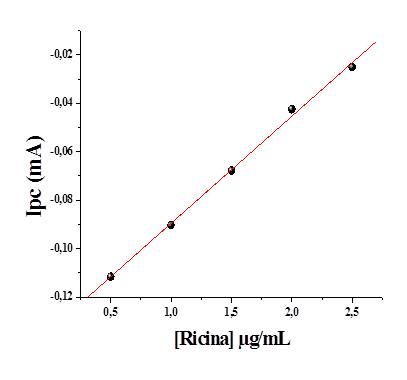
Figura 2
CONCLUSÕES: Os resultados obtidos indicaram que o biossensor pode ser aplicado na determinação
da ricina em amostras de torta de mamona, logo que a dose letal desta lectina para
animais de grande porte está em torno de 1,0 mg/kg. O biossensor desenvolvido,
baseado em fibras de carbono, foi inovador, prático e de baixo custo sem igual no
mercado.
AGRADECIMENTOS: FACEPE, FINEP E UFPE.
REFERÊNCIAS BIBLIOGRÁFICA: AZEVEDO, D.M.P.; LIMA, E.F. 2001. O Agronegócio da mamona no Brasil. Embrapa Informação Tecnológica, 2ª edição, Brasília – DF.
BELTRÃO, N. E. M. 2005. Torta de mamona (Ricinus communis L.): fertilizante e alimento. Comunicado técnico Embrapa, 171.
RIBEIRO, N. M.; AVILA-FILHO, F. D. F. 2006. Métodos para desintoxicação de tortas de oleaginosas. In: Anais do I Congresso da Rede Brasileira de Tecnologia de Biodiesel, Brasília – DF.
SPIVAK, L; HENDRICKSON, R. G. Ricin. Critical Care Clinics, 21: 815-824, 2005.
FELTIS, B. N.; SEXTON, B. A.; GLENN, F. L.; BEST, M. J.; WILKINS, M.; DAVIS, T. J. 2008. A Hand-held Surface Plasmon Resonance Biosensor for the Detection of Ricin and Other Biological Agents. Biosensors and Bioelectronics, 23: 1131-1136.
RASOOLY, A.; JACOBSON, J. 2006. Development of biosensors for cancer clinical testing. Biosensors and Bioelectronics, 21(10): 1851-1858.
VADDIRAJU, S.; TOMAZOS, I.; BURGESS, D. J.; JAIN, F. C.; PAPADIMITRAKOPOULOS, F. 2010. Emerging synergy between nanotechnology and implantable biosensors: a review. Biosensors and Bioelectronics, 25: 1553-1565.
WU, J. H.; SINGH, T.; HERP, A.; WU, A. M. 2006. Carbohydrate recognition factors of the lectin domains present in the Ricinus communis toxic protein (ricin). Biochimie, 88: 201–217.
