ÁREA: Bioquímica e Biotecnologia
TÍTULO: Isolamento de Microrganismos do Solo da Agroindústria Sucroalcooleira Produtores de Enzimas e Polímeros de Interesse Biotecnológico.
AUTORES: Padilha, I.Q.M. (UFPB) ; Grisi, T.C.S.L. (UFPB) ; Carvalho, L.C.T. (UFPB) ; Dias, P.V.S. (UFPB) ; Araújo, D.A.M. (UFPB)
RESUMO: A biodiversidade microbiana do solo é responsável pela produção de centenas de substâncias, como enzimas, polímeros e antibióticos. Este trabalho tem como objetivo geral o estudo de amostras de solo da Agroindústria Sucroalcooleira para prospecção de produtos biotecnológicos. Foram isoladas 55 bactérias em meio contendo CMC e em diferentes temperaturas. Os resultados mostram que os microrganismos produtores pertencem aos gêneros Bacillus (CMCase/Xilanase/Amilase/Protease), Exiguobacterium (Amilase/Protease), Paenibacillus (EPS), Klebsiella (EPS), Pseudomonas (PHB), Agrobacterium (EPS) e Stenotrophomonas (Amilase/Protease/EPS). Os resultados demonstram o alto potencial biotecnológico dos microrganismos, baseado no uso sustentado da biodiversidade e dos seus recursos derivados.
PALAVRAS CHAVES: Solo; Microrganismos; Enzimas/polímeros
INTRODUÇÃO: O solo é um habitat bastante peculiar com relação a outros habitats terrestres devido à sua natureza heterogênea complexa e dinâmica. A biota do solo inclui representantes de todos os grupos de microrganismos (bactérias, fungos, algas). A presença de um microrganismo específico em determinado solo é função das condições ambientais dominadas e dos limites de sua bagagem genética. Algumas espécies de microrganismos podem sobreviver em condições extremas de salinidade, temperatura, pressão e pH. Além disso, os microrganismos, de modo geral, são bastante versáteis em adaptar-se a mudanças ambientais. Limitações físicas (umidade, aeração, porosidade) e químicas (disponibilidade de nutrientes e toxicidade de elementos como metais pesados) podem ocorrer nos solos, porém muitas espécies são capazes de se adaptar a essas condições (MOREIRA; SIQUEIRA, 2002).
A biodiversidade microbiana do solo é responsável pela descoberta de centenas de substâncias como enzimas, antibióticos, entre outras. (LORENZ e JÜRGEN, 2005). Está se descobrindo cada vez mais funções gênicas, particularmente, para propósitos industriais. Este fato indica que a utilização de biotecnologia constitui uma opção viável e uma ferramenta fundamental para o uso sustentável e agregação de valor.
A prospecção de enzimas e polímeros a partir da identificação de novas cepas pode contribuir significativamente para a descoberta de novos produtos biotecnológicos.
Dessa forma, este trabalho tem como objetivo isolar bactérias mesofílicas e termofílicas presentes no solo cultivado quanto à produção de enzimas (amilases, celulases e proteases) e polímeros (polihidroxibutirato e exopolissacarideo), tal como realizar a identificação molecular das bactérias produtoras pelo estudo do gene 16S rDNA.
MATERIAL E MÉTODOS: Área de Estudo, Coleta e Análise de Amostras de Solo: as amostras de solo foram coletadas na Usina Japungu Agroindustrial S.A, localizada em Santa Rita – PB, de acordo com o método simples (EMBRAPA, 1999).
Isolamento das Bactérias: 25 g do solo foi adicionado a 225 mL de solução de Ringer. Foram realizadas demais diluições As placas foram incubadas a 37º e 55 °C, após 24-48 h, as colônias bacterianas foram repicadas para um tubo estoque.
Amplificação do gene 16S rRNA e Sequenciamento: a extração de DNA genômico das linhagens foi realizada com o AxyPrep Bact .Gen. DNA Kit (Axygen Bioscience). Os genes 16S rRNA foram amplificados utilizando os seguintes primers universais: 27F e 1525R. Para a PCR (Reação em Cadeia da Polimerase), foi utilizado kit de PCR Master MIX (Promega, Madison, USA). As amostras foram seqüenciadas em seqüenciador automático, ABI 3100 (Applied Biosystems).
Análises das seqüências: as sequências selecionadas foram comparadas ao banco de sequências não redundantes do GenBank usando-se BLASTn. Árvores filogenéticas foram geradas com o software MEGA5.0.
Atividade Enzimátia: os isolados foram inoculados diferentes meio contendo leite em pó desnatado, amido, CMC e xilano. Após período de 3 dias a 37º C, observou-se a presença de halos claros de degradação ao redor das colônias.
Índice Enzimático (IE): foi avaliado de acordo com HANKIN e ANAGNOSTAKIS (1975), determinado pela medida do diâmetro do halo de degradação dividido pelo diâmetro da colônia (mm).
Produção PHB (polihidroxibutirato) e EPS (exopolisacarídeos): os isolados foram cultivados em meio mínimo desbalanceado (MMD) com sacarose. A produção de PHB foi verificada após cinco dias de incubação a 37° C, pela intensidade da coloração por Sudan Black (SB) do crescimento bacteriano.
RESULTADOS E DISCUSSÃO: A partir do solo de cultivo de cana de açúcar e da torta de filtro, foram isoladas 55 bactérias em meio contendo CMC e em diferentes temperaturas (37ºC e 55ºC). Destas, 22 isolados apresentaram alguma atividade enzimática extracelular (Figura 1). Foram isoladas 23 cepas em meio MMD-sacarose, sendo que 5 isolados produziram PHB e 7 isolados produziram EPS. Os resultados mostram que os microrganismos produtores pertencem aos gêneros Bacillus (CMCase/Xilanase/Amilase/Protease), Exiguobacterium (Amilase/Protease), Paenibacillus (EPS), Klebsiella (EPS), Pseudomonas (PHB), Agrobacterium (EPS) e Stenotrophomonas (Amilase/Protease/EPS) (Figura 2). O gênero Bacillus é conhecido por produzir uma variedade de enzimas extracelulares (HAGIHARA et al., 2001; SETYORINI et al., 2006). Além disso, linhagens de Stenotrophomonas maltophilia produtoras de amilases foram isoladas de diferentes habitats (solo e água) (JACOBI et al.,1996).
A presença de EPS em Pseudomonas aeruginosa tem sido estudada por Celik e colaboradores (2007), e em Streptococcus mutans por Vimala e Lalithakumari (2003). Vários trabalhos relatam a produção de EPS por Bacillus sp. (CORSARO et al. 1999; LARPIN et al. 2002), embora apenas poucas descrições sobre a produção de EPS por espécies do gênero to Paenibacillus (PRADO-ACOSTA et al. 2005). Este gênero tem produzido EPS de alta viscosidade com propriedades pseudoplásticas superiores. Outras espécies do gênero Pseudomonas e Agrobacterium (TRIVENI et al., 2001) também mostraram capacidade de produzir EPS com diferentes propriedades. Diversos microrganismos são conhecidos pela capacidade de acumular PHA em altas concentrações (STEINBUCHEL e FUCHTENBUSH, 1998), incluindo Ralstonia eutropha e várias espécies de Pseudomonas (REN et al., 2005; SLATER et al., 1998).
Figura 1
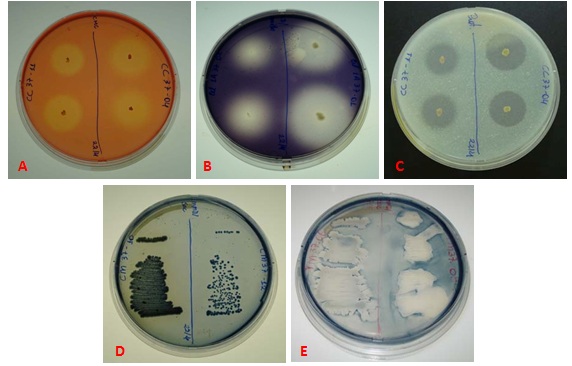
Atividade CMCase em "A"; Atividade amilolítica em "B"; Atividade proteolítica "C". Produção de PHB em "D" e produção de EPS "E".
Figura 2
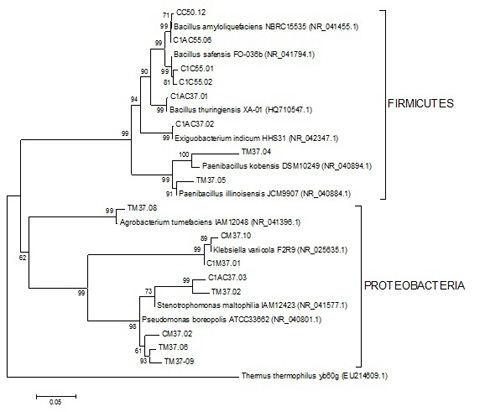
Árvore filogenética baseada nas sequências do gene 16S rDNA dos linhagens isolados do solo com sequências conhecidas do GenBank.
CONCLUSÕES: Os resultados demonstram o alto potencial biotecnológico dos microrganismos isolados como produtores de enzimas e biopolímeros, baseado no uso sustentado da biodiversidade e dos seus recursos derivados, agregando valor para os diferentes setores produtivos.
AGRADECIMENTOS: RENORBIO; suporte financeiro do CNPq/CAPES e o auxílio técnico do Dr. Breno Grisi, Dra. Krystyna Lira (UFPB)e Dante Guimarães da Japungu Agroindustrial S/A.
REFERÊNCIAS BIBLIOGRÁFICA: CELIK, G.Y; ASLIM, B; BEYATLI, Y. (2008) Characterization and production of the exopolysaccharide (EPS) from Pseudomonas aeruginosa G1 and Pseudomonas putida G12 strains. Carbohydrate Polymersk, 73(1):178-182.
CORSARO, M.M.; GRANT, W.D.; GRANT, S.; MARCIANO, C.E. & PARILLLI, M. (1999) Structure determination of an exopolysaccharide from an alkaliphilic bacterium closely related to Bacillus spp. European Journal of Biochemistry, 264:554–561.
EMBRAPA. Empresa Brasileira de Pesquisa Agropecuária. Centro Nacional de Pesquisa de Solos. Manual de métodos de análise de solo. 2.ed. Rio de Janeiro: Embrapa-CNPS, 1997. 212p.
HAGIHARA, H.; IGARASHI, K.; HAYASHI, Y.; ENDO, K.; IKAWA-KITAYAMA, K.; OZAKI, K.; KAWAI, S. & ITO, S. (2001) Novel alpha-amylase that is highly resistant to chelating reagents and chemical oxidants from the alkaliphilic Bacillus isolate KSM-K38. Applied and Environmental Microbiology, 67(4):1744-50.
HALL, T.A. (1999) BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series, 41, 95–98.
HANKIN, L. e ANAGNOSTAKIS, S. L. (1975), The use of solid media for detection of enzyme production by fungi. Mycologia, 67:597-607.
JACOBI, M., KAISER, D.; BERG, G.; JUNG, G.; WINKELMANN, G. & BANL, H. (1996) Maltophilin, a new antifungal compound produced by Stenotrophomonas maltophilia R3089. Journal of Antibiotics, 49:1104-1109.
LORENZ, P. e JÜRGEN, E. (2005) Metagenomics and industrial applications. Nature Reviews Microbiology, 3:510-516.
MOREIRA, F.M.S.; SIQUEIRA, J.O. Microbiologia e bioquímica do solo. Lavras: Editora UFLA, p. 262. 2002.
PRADO-ACOSTA, M.; VALDMAN, E.; LEITE, S.G.F. & RUZAL, S.M. (2005) Biosorption of copper by Paenibacillus polymyxa cells and their exopolysaccharide. World Journal of Microbiology and Biotechnology, 21:1157–1163.
REN, Q.; DE ROO, G.; VAN BEILEN, J.B.; ZINN, M.; KESSLER, B. & WITHOLT, B. (2005) Poly(3-hydroxy -alkanoate) polymerase synthesis and in vitro activity in recombinant Escherichia coli and Pseudomonas putida. Applied Microbiololy and Biotechnology, 69: 286-292.
SETYORINI, E.; TAKENAKA, S.; MURAKAMI, S. & AOKI, K. (2006) Purification and Characterization of Two Novel Halotolerant Extracellular Proteases from Bacillus subtilis Strain FP-133. Bioscience, Biotechnology, and Biochemistry, 70:433–440.
SLATER, S.; HOUMIEL, K.L.; TRAN, M.; MITSKY, T.A.; TAYLOR, N.B.; PADGETTE, S.R.; GRUYS, K.J. (1998) Multiple -ketothiolases mediate poly( -hydroxyalkanoate) copolymer synthesis in Ralstonia eutropha. Journal of Bacteriology, 180:1979-1987.
STEINBÜCHEL, A.E. e FÜCHTENBUSH, B. (1998) Bacterial and other biological systems for polyester production. Trends Biotechnol 16:419–427.
TRIVENI, R.; SHAMALA, T.R. & RASTOGI, N.K. (2001). Optimised production and utilisation of exopolysaccharide from Agrobacterium radiobacter. Process Biochemistry, 36:787–795.
VIMALA, P. eLALITHAKUMARI, D. (2003) Characterization of exopolysaccharide (EPS) produced by Leuconostoc sp. V 41. Asian Journal of Microbiology, Biotechnology and Environmental Sciences, 5(2): 161-165.
