ÁREA: Bioquímica e Biotecnologia
TÍTULO: PRODUÇÃO DE LIPASE A PARTIR DE MEIOS ALTERNATIVOS UTILIZANDO Bacillus licheniformis
AUTORES: Tavares, L.L.P. (FAMASUL) ; Evandro, L.F. (FAMASUL) ; Ardilles, S.L. (FAMASUL) ; Anderson, F.S.S. (FAMASUL) ; Alice, S.F.S. (FAMASUL) ; Ismillanni, D.O. (FAMASUL)
RESUMO: A disponibilidade comercial é um inconveniente no ponto de vista econômico do uso de enzimas por não serem empregadas em larga escala, devido a sua sensibilidade às variações do meio reacional, portanto, faz-se necessário a busca de novos substratos para produzir enzimas com menor custo. O objetivo do presente trabalho foi estudar a produção de enzimas lipolíticas em fermentação submersa, para tanto foram utilizadas culturas de bactérias do gênero Bacillus licheniformis. As amostras foram submetidas à construção da curva de crescimento, determinação do pH e da atividade lipolítica. Os resultados indicaram que a bactéria apresentou um melhor crescimento no Meio A, com valores de pH entre 6,29 e 7,29. Na detecção da atividade lipolítica, o meio A produziu 241,4 (U/ml) e o meio B 125 (U/mL)
PALAVRAS CHAVES: lipase; Bacillus licheniformis; enzimas
INTRODUÇÃO: As Lipases (E.C.3.1.1.3, triacilglicerol acilhidrolases) são enzimas que ocupam um lugar de destaque entre os biocatalisadores e têm muitas aplicações, motivo este que faz crescer significativamente sua participação no mercado mundial de enzimas industriais. As lipases, no futuro, terão importância industrial e comercial comparável às das peptidases, cuja venda entre as enzimas industriais, alcança 25 a 40% (SAXENA, et al., 2003; HASAN et al., 2006; FREIRE & CASTILHO, 2008; CAI et al., 2009).
As lipases podem ser comumente encontradas na natureza e são obtidas a partir de fontes animais, vegetais e microbianas. Numerosas espécies de bactérias, leveduras e fungos filamentosos são produtoras de lipases. (CONTESINI et al., 2009; AÇIKEL et al., 2010).
Em ambientes com baixa atividade de água, catalisam a reação inversa de esterificação, levando à formação de acilgliceróis a partir de ácidos graxos e glicerol. Portanto, a hidrólise de gorduras e óleos é direcionada pelo conteúdo de água da mistura de reação.(HASAN et al., 2006; FREIRE & CASTILHO, 2008; CONTESINI et al., 2009; AÇIKEL et al., 2010; RIGO et al., 2010).
Além da reação de síntese de éster, as lipases catalisam reações de transesterificação, que são mais importantes para processos biotecnológicos, nos quais o doador do grupo acila é um éster. Já nas interesterificações catalisadas por lipases, o grupo acila é trocado entre duas moléculas de éster (CARVALHO et al, 2003; PIZARRO & PARK, 2003; COLEN, 2006).
O gênero Bacillus é considerado como um dos maiores produtores de substâncias biotecnológicas.(JORGENSEN et al., 2000; FENG et al., 2001; CHANTAWANNAKUL et al., 2002; DEMAIN, and ADRIO, 2008). O estudo teve como objetivo verificar a produção de lipase por Bacillus licheniformis em diferentes meios.
MATERIAL E MÉTODOS: Micro-organismo: Foi utilizado Bacillus licheniformis, localizado no laboratório de microbiologia da Faculdade de Formação de Professores da Mata Sul (FAMASUL). A cultura foi mantida em meio Ágar Nutritivo (AN)
Meios de produção: Foram testados dois meios de produção de lipase, denominados de A (glicose 1,0%, extrato de levedura 0,5%, peptona 2,0%, NaNO3 0,1%, KH2PO4 0,1%, MgSO4. 7H2O 0,05%, óleo de oliva 1%, água destilada 1000 mL, pH 6,5) e meio de produção B (peptona 1,0%g, NaCl 0,5%, CaCl2. 2H2O 0,01%, óleo de soja 1%, água destilada 1000 mL, pH 6,0.
Pré-inóculo: A amostra de B. licheniformis, foi transferida para Erlenmeyers de 1000mL de capacidade, contendo Caldo Nutritivo, a 37°C em 150 rpm, por aproximadamente 12 horas.
Curva de Crescimento: O crescimento ocorreu em agitador orbital, em 150 rpm, a 37°C, por 96 h em triplicata, com amostras coletadas a cada 4 horas. Detecção da Atividade Lipolítica: Foi determinada pela metodologia descrita por Soares et al. (1999). As atividades foram expressas em (1 U/mL = 1 μmoles/mL. min).
Cálculo da atividade enzimática
A atividade enzimática de lipase foi calculada através da equação segundo SOARES, et., al. (1999)
AE (U/mL) = (Va -Vb) x N x 1000 /t x Vc
onde: AE é a atividade lipolítica (U/mL); Va é o volume da amostra titulada (mL); Vb é o volume do branco titulado (mL); Vc é o volume da amostrautilizada na reação (mL); N é a normalidade da solução de KOH (mol/L); t é o tempo de reação em minutos. ( SOARES, et. al., 1999)
RESULTADOS E DISCUSSÃO: Verificou-se um melhor crescimento (figura 1) de B. licheniformis no meio A, com auge entre 64 e 72 horas, posteriormente ocorreu um declínio marcante não observada no outro meio. O meio B, apresentou um crescimento constante até 24 horas, onde seu auge foi determinando neste ponto.
Durante as primeiras horas de produção, os valores do pH do meio B, aumentaram atingindo a neutralidade, apresentando pequenas variações até chegar a atingir no final valores acima de 8,0. Enquanto o meio A, apresentou decréscimo a partir das primeiras horas, chegando a atingir valores na faixa de 6,11 e com 24 horas houve um aumento atingindo a neutralidade. MOHAN et al, (2008) relataram que alguns micro-organismos apresentam atividades elevadas, quando cultivados em meio contendo glicose. O pH inicial do meio é extremamente importante para produção de lipases. ERTUGRUL et al, (2007) relataram que a utilização de meios com um pH inicial moderadamente ácido (6,0 – 6,5), otimizam a produção de lipase em amostras de Bacillus sp.
Avaliando-se a atividade lipolítica (TABELA 1), constatou-se a maior atividade no meio A equivalente a 241,4 (U/mL), com 68 horas, pH 7,14, e no meio B, 126 (U/mL), em 80 horas, pH 8,18. FEITOSA, (2009) em seu trabalho com bactéria isolada de solo com histórico de contato com petróleo, produziu 4617 U/mL a 37ºC no pH 7,0 em 120h de fermentação. Já KANWAR et al.(2002), alcançaram uma atividade lipolítica de 25 U/mL, a 34ºC e pH 8,0, utilizando, as bactérias Pseudomonas G6, isoladas de solo contaminado com petróleo. Enquanto que Padilha et al. (2011), em pH 8,0 o melhor resultado foi de 2,38 U/mL. Para Dheeman et al. (2010), a produção de lipase, pode está relacionada com a quantidade de ácidos graxos poliinsaturados presente no óleo de oliva.
FIGURA 1
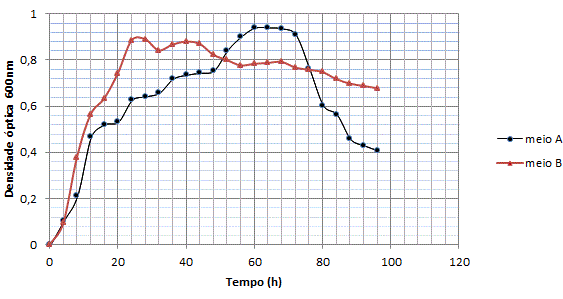
Cinética de crescimento do Bacillus licheniformis
FIGURA 2
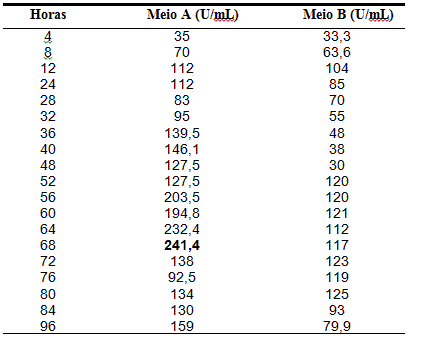
Atividade lipolítica do Bacillus licheniformis durante 96 horas de fermentação em U/mL.
CONCLUSÕES: O Bacillus licheniformis apresenta capacidade para produção de lipase utilizando meios alternativos,
A implementação dos meios a base de óleos naturais aumentam a atividade da produção de lipase;
O óleo de oliva como fonte de carbono teve diferente efeito na produção de lipase, constituindo assim uma alternativa viável para a produção de substâncias de interesse econômico.
A produção de lipase demonstrou ser eficiente, utilizando meios relativamente econômicos,no entanto, vale ressaltar considerações para trabalhos futuros visando à melhoria na eficiência do processo de produção.
AGRADECIMENTOS: CAPES, CNPQ, FACEPE
REFERÊNCIAS BIBLIOGRÁFICA: Açikel, U.; Eran, M.; Açikel, Y.S. (2010), Optimization of critical medium components using response surface methodology for lipase production by Rhizopus delemar. Food Bioprod. Proc., v. 8, p. 31-39.
ARBTER, F.; VARDANEGA, R.; DE OLIVEIRA, D.; TREICHEL, H. Lipase production by solid fermentation of soybean meal with different supplements LWT - Food Sci. Technol. (2010), doi: 10.1016/j.lwt.2010.03.002.
Cai, J.; Hsiao, B.S.; Gross, R. A. (2009), Polypentadecalactone prepared by lipase catalysis: crystallization kinetics and morphology. Polymer International v. 58, Issue 8, p. 944 – 953.
Chantawannakul, P., Oncharoen, A., Klanbut, K., Chukeatirote, E. and Lumyong, S. (2002), Characterization of Proteases of Bacillus subtilis strain 38 isolated from Traditionally Fermented Soybean in Northern Thailand, ScienceAsia, v.28, p. 241-245.
COLEN, G.; JUNQUEIRA, R.G; MORAES-SANTOS, T. Isolation and screening of alkaline lipase-producing fungi from Brazilian savanna soil. World J. Microb. Biotech., v. 22, p.881–885, 2006.
CONTESINI, F.J.; SILVA, V.C.F; MACIEL, R.F.; LIMA R.J.; BARROS, F.F.C; CARVALHO, P.O. Response surface analysis for the production of na enatioselective lipase from Aspegillus niger by solid-state fermentation. The J. Microbiol., v. 47, p. 563-571, 2009.
Demain, A.L e Adrio, J.L. (2008), Contributions of Microorganisms to Industrial Biology, Molecular Biotechnology, v.38, p. 41–55.
Dheeman, D.S.; Henehan, G.T.M.; and Frías, J.M. (2010), Purification and Properties of Amycolatopsis mediterranei DSM 43304 lipase and its potential in flavour ester synthesis Bioresource Technology, v. 102, p. 3373-3379
Ertugrul, S.; Donmeza, G. and Takaç, S. (2007), Isolation of lipase producing Bacillus sp.from olive mill wasteater and improving its enzyme activity, Journal of Hazardous Materials, v. 149, Issue 3, p. 720 – 772.
Feitosa, I. G. (2009), Produção de enzima lipolíticas utilizando bactéria isolada de solo com histórico de contato com petróleo em fermentação submersa. 90p. Dissertação de Mestrado, Universidade Tiradentes, Aracaju, Brasil.
Feng, Y. Y., Yang, W. B., ONG, S. L., HU, J. Y. and NG, W. J. (2001), Fermentation of Starch for Enhanced Alkakine Protease Production by Constructing an Alk alophilic Bacillus pumilus Strain, Appl. Microbiol. Biotechnol., v.57, p. 153-160.
Freire, D.M.A; Castilho, L.R. (2008), Lipases em biocatálise, produção, aplicações e mercado. Enzimas em biotecnologia, p.506, Editora Interciência, Rio de Janeiro, Brasil.
Hasan, F.; Shah, A.A.; Hameed, A. (2006), Industrial applications of microbial lipases. Enz. Microb. Technol., v. 39, p. 235-251, 2006.
Jaeger, K.E., Ransac, S., Dijkstra, B.W., Colson, C., Van Heuvel, M. and Misset, O. (1994), Bacterial Lipases, FEMS Microbiology Reviews, v. 15, p. 29-63.
Jorgensen, P.L., Tangney, M., Pedersen, P.E., Hastrup, S., Diderichsen, B. and Jorgensen, S. (2000), Cloning and Sequencing of na Alkaline Protease Gene from Bacillus lentus and Amplification of the Gene on the B. lentus Chromosome by na Improved Technique, Applied and Environmental Microbiology, v. 66, p. 825-827.
Kanwar, L.; Gogoi, B. K.; Goswami, P. (2002), Production of a Pseudomonas lipase in n-alkane substrate and its isolation using an improved ammonium sulfate precipitation technique. Bioresource Technology, v.84, p. 207–211.
Logan, N. A. and DE Vous, P. (1998), Bacillus et Industrie, Bulletin de la Societé Française de Microbiologie, v.13, p. 130- 136.
Mohan, T.S., A. Palavesam and G. Immanvel, 2008. Isolation and characterization of lipase-producing Bacillus strains from oil mill waste. Afr. J. Biotechnol., 7: 2728-2735.
PADILHA, Giovana Silva et al . Avaliação da lipase extracelular de Pseudomonas cepacia para purificação em sistema bifásico aquoso. Ciênc. Tecnol. Aliment., Campinas, v. 31, n. 1, Mar. 2011 .
PIZARRO, A.V.L.; PARK, E.Y. Lipase-catalysed production of biodiesel fuel from vegetable oils contained in waste activated bleaching earth. Process Biochem., v. 38, p. 1077- 1082, 2003.
RIGO, E.; NINOW, J.L.; DI LUCCIO, M.; OLIVEIRA, V.; POLLONI, E.; REMONATTO, D.;
Saxena, R.K.; Sheoran, A.; Giri, B.; Davidson, S.W. (2003), Purification strategies for microbial lipases. J. Microbiol. Methods, v. 52, p. 1-18.
SOARES, C. M. F.; CASTRO, H. F.; MORAES, F. F.; ZANIN, G. M. Characterization and utilization of Candida rugosa lipase immobilized on controlled pore silica. Applied Biochemistry and Biotechnology, v. 79, n. 1-3, p. 745-758, 1999.
