ÁREA: Bioquímica e Biotecnologia
TÍTULO: SÍNTESE, CARACTERIZAÇÃO E PRODUÇÃO DE CONJUGADO COM LECTINA DO DIMETIL-2-(ACRIDIN-9-ILMETILENO)MALONATO
AUTORES: Almeida, S.M.V. (LIKA-UFPE) ; Lafayette, E.A. (UFPE) ; Alcantara, F.F. (UFPE) ; Silva, L.P.B.G. (LIKA-UFPE) ; Botelho, S.P.S. (UFPE) ; Galdino, S.L. (UFPE) ; Lima, M.C.A. (UFPE) ; Pitta, I.R. (UFPE) ; Beltrão, E.I.C. (LIKA-UFPE) ; Carvalho Júnior, L.B. (LIKA UFPE)
RESUMO: Este trabalho teve por objetivo sintetizar e caracterizar as propriedades luminescentes do derivado de acridina (LPSF/IP-81) e seu conjugado com a lectina Concanavalina A (Con A). A síntese foi realizada a partir de AC-2 e dimetilmalonato, por aquecimento à 110 °C por 24 h com rendimento de 33%. Avaliação por técnicas espectroscópicas mostrou que o LPSF/IP-81 é fotoluminescente por meio de excitação em 360 nm, e emissão por volta de 428 nm com rendimento quântico de 2%. LPSF/IP-81 foi conjugado com Con A e separado usando cromatografia de exclusão molecular com Sephadex G-25. O conjugado foi avaliado por meio da atividade hemaglutinante, conteúdo protéico e luminescência. Medidas de fluorescência demonstraram manutenção das propriedades luminescentes do LPSF/IP-81 após conjugação.
PALAVRAS CHAVES: Derivado de acridina; lectina; luminescência
INTRODUÇÃO: Marcadores luminescentes podem ser usados para conjugação e detecção de materiais biológicos, porque estas moléculas são estáveis, sensíveis e existe, atualmente, uma ampla faixa de métodos disponíveis para a marcação de biomoléculas. Tipicamente, o espectro de emissão de um marcador fluorescente é uma propriedade característica do composto e sua intensidade serve para detectar materiais marcados com tais compostos (MOCZAR et al., 2010).
As acridinas são compostos heterocíclicos que possuem a habilidade de interagir com outros componentes (KRZYMINSKI et al., 2011). Por isso, esses compostos podem ser aplicados em diversas áreas, como diagnóstico (KRICKA, 2003) e terapêutica (APPLETON et al., 2010). Estes compostos possuem habilidade para interagir com radiação Ultravioleta-Visível por causa de absorção relativamente forte e emissão na região do visível. Como resultado, derivados de acridina podem ser potencialmente usados como sensores espectrais ou como marcadores fluorescentes (KRZYMINSKI et al., 2008).
Uma aplicação de éster de acridina é conseguida por meio de sua ligação a uma classe de proteínas denominadas lectinas que reconhecem carboidratos livres ou ligados (CAMPOS et al., 2006). O conjugado lectina-éster de acridina é adequado para diferenciação de tecidos neoplásicos malignos, benignos ou sadios. Dessa forma, a síntese, a caracterização e posterior aplicação de derivados de acridina em técnicas de identificação de biomarcadores teciduais ou séricos abrem novas possibilidades de aplicação desta classe de moléculas.
Por isso, este trabalho teve como objetivo sintetizar e caracterizar parcialmente as propriedades luminescentes do derivado de acridina LPSF/IP-81, bem como de seu conjugado com a lectina Con A.
MATERIAL E MÉTODOS: O LPSF/IP-81 foi sintetizado no Laboratório de Planejamento e Síntese de Fármacos do Departamento de Antibióticos da UFPE. A síntese do LPSF/IP-81 foi feita de acridina-9-carboxialdeído (LPSF/AC-2) (P.M.=207) e dimetilmalonato (M.M. 132,12, d=1,156), em meio benzênico e morfolina como catalisador, todos em concentrações equimolares. Os reagentes necessários à síntese foram colocados em balão sob agitação em condensador à 110ºC com deanstarck acoplado. Todas as etapas foram acompanhadas por Cromatografia de Camada Delgada (CCD) com o sistema n-hexano/acetato de etila (7:3). A reação durou 24 horas, o solvente foi evaporado e o balão armazenado a -20° C. Em seguida, o LPSF/IP-81 foi purificado por cromatografia tipo “flash” (sob pressão) em sílica gel 60 Merck, iniciando com o n-hexano, depois com n-hexano/acetato de etila (9,5:0,5) e por fim, com a proporção 9:1. A confirmação da estrutura química foi feita por absorção no infravermelho e espectometria de massa e foram determinadas as propriedades físico-químicas, como ponto de fusão, rendimento, razão de frente e luminescência.
Absorção UV-Vis foi avaliada em espectrofotômetro Ultraspec 3000 PRO por varredura de 200-900nm. Os máximos de absorção foram utilizados como comprimentos de onda para verificação inicial das emissões na espectroscopia de luminescência. As medidas de fluorescência foram feitas em espectrofluorímetro JASCO FP-6300. O rendimento quântico luminescente foi avaliado de acordo com Demas e Crosby (1971) com sulfato de quinina foi utilizado como padrão. O LPSF/IP-81 foi submetido ao processo de conjugação conforme descrito por Weeks e colaboradores (1983). Para avaliação da ligação entre LPSF/IP-81 e lectina, os conjugados obtidos foram analisados por cromatografia de exclusão de tamanho (Sephadex G-25).
RESULTADOS E DISCUSSÃO: O LPSF/IP-81 foi sintetizado após 24 h do início da reação através de confirmação por CCD. O rendimento da reação foi de 33,4%.
Cristais amarelos. Fórmula química: C19H15NO4. C 72,02%; H 4,71%; N 4,36%; O 19,92% Massa molecular calculada: 321,1001 g/Mol, encontrada 322,0617 g/Mol. Ponto de fusão: 132-134 °C. Rf: 0,43 (n-hexano/acetato de etila 7:3)
IV (KBr, cm-1) υmax: 2954, 2924, 1730, 1628, 1435, 1266, 1232, 1076, 785, 749. 1H NMR (300 MHz, DMSO-d6) δ 3.15 (3H, s), δ 3.92 (3H, s), δ 7.65 (2H, m), δ 7.89 (2H, m), δ 7.99 (2H, d, J = 8,69 Hz), δ 8.20 (2H, d, J = 8.69 Hz), δ 8.70 (1H, s).
O LPSF/IP-81 mostrou dois picos de absorção (250 e 360 nm). O maior em 250 nm é característico de compostos que possuem o anel acridina (BOUZYK et al., 2003). O coeficiente de extinção molar em 360 foi de 9.838 M-1cm-1. A fluorescência foi cerca de 2 vezes maior quando excitado em 361 nm que em 250 nm. Por isso o comprimento de onda de excitação utilizado foi 360 nm. A figura 1 mostra a absorção, excitação e emissão do LPSF/IP-81. O rendimento quântico do LPSF/IP-81 foi 2%, valor de acordo com outros derivados de acridina (KRZYMINSKI et al., 2010).
O perfil das soluções submetidas à conjugação pode ser visualizado na figura 2. A sobreposição (alíquotas de 8 a 15) dos picos de proteína e fluorescência indica interação entre a proteína e LPSF/IP-81. Além de manter emissão semelhante ao composto isolado, o conjugado também mostra excitação nos mesmos comprimentos de onda do LPSF/IP-81 isolado. A forma mais comum para detecção de lectinas é o teste da Atividade Hemaglutinação (AH) (KENNEDY et al., 1995). Em nenhuma das conjugações houve perda da AH. Isso indica, que a interação entre LPSF/IP-81 e Con A não altera os sítios de reconhecimento a carboidratos da proteína.
Figura 1
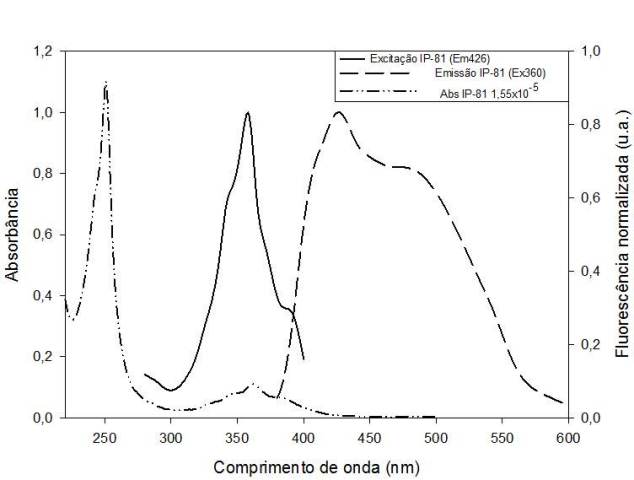
Espectros de absorção, excitação e emissão do LPSF/IP-81 (IP-81) diluído em PBS (1,55 x 10[sup]-5[/sup]). Excitação em 360 nm e emissão em 428.
Figura 2
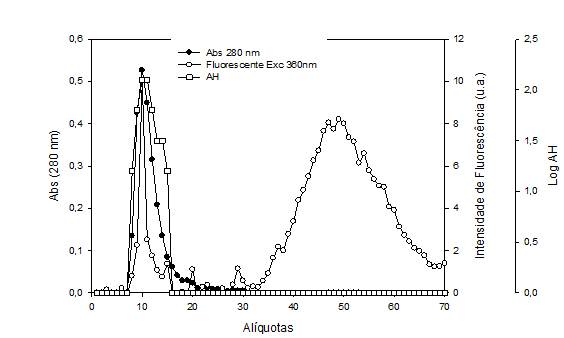
Perfil protéico (280 nm), fotoluminescente (λExc 360) e hemaglutinante das alíquotas colhidas da coluna de exclusão molecular.
CONCLUSÕES: O LPSF/IP-81 foi sintetizado e teve sua estrutura química elucidada. Este mostrou-se fotoluminescente com excitação em 360 nm e emissão em 428 nm. O rendimento quântico luminescente do LPSF/IP-81 foi de 2 %. O processo de conjugação do LPSF/IP-81 com a lectina Con A não alterou as propriedades luminescentes do LPSF/IP-81, nem a estrutura terciária da proteína, o que foi confirmado por meio de métodos cromatográficos, espectroscopia de luminescência, e atividade hemaglutinante para o conjugado obtido. Os resultados indicam que o LPSF/IP-81 pode ser usado como revelador luminescente.
AGRADECIMENTOS: Autores agradecem ao CNPq e FACEPE pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: APPLETON, D.R.; PEARCE, A.N.; COPP, B.R. Anti-Tuberculosis natural products: synthesis and biological evaluation of pyridoacridine related to ascididemin. Tetrahedron 66, 4977-4986, 2010.
BOUZYK, A., JOZWIAK, L.; KOLENDO, A.Y.; BLAZEJOWSKI, J. Theoretical interpretation of electronic absorption and emission transitions in 9-acridinones. Spectrochimica Acta Part A, 59, 543-558, 2003.
CAMPOS, L.M.; CAVALCANTI, C.L.B.; LIMA-FILHO, J.L.; CARVALHO-JR. L.B.; BELTRÃO, E.I.C. Acridinium Ester conjugated to lectin as chemiluminescent histochemistry marker. Biomarkers 11(5): 480 – 484, 2006.
DEMAS, J. N.; and CROSBY, G. A. The Measurement of Photoluminescence Quantum Yields. A Review. Journal of Physical Chemistry., 1971, 75, 991.
KENNEDY, J.F.; PAIVA, P.M.G.; CORREIA, M.T.S.; CAVALCANTI, M.S.M.; COELHO, L.C.B.B. Lectins, versatile proteins of recognition: a review. Carbohydrate Polymers. 26: 219-230, 1995.
KRICKA, L.J. Clinical applications of chemiluminescence. Analytica Chimica Acta 500, 279–286, 2003.
KRZYMINSKI, K.; ROSHAL, A.D.; ZADYKOWICZ, B.; BIALK-BIELINSKA, A.; SIERADZAN, A. Chemiluminogenic properties of 10-methil-9-(phenoxycarbonyl)acridinium cations in organic environments. Journal of Physical Chemistry A, 114, 10550-10562, 2010.
KRZYMINSKI, K.; OZOG, A.; MALECHA, P.; ROSHAL, A.D.; WROBLEWSKA, A.; ZADYKOWICZ, B.; BLAZEJOWSKI, J. Chemiluminogenic features of 10-methyl-9-(phenoxycarbonyl)acridinium trifluoromethanesulfonates alkyl substituted at the benzene ring in aqueous media. Journal of Organic Chemistry, 76, 1072-1085, 2011.
KRZYMINSKI, K.; ROSHAL, A.D.; NIZIOLEK, A. Spectral features of substituted 9-(phenoxycarbonyl)-acridines and their protonated and methylated cation derivatives. Spectrochimica Acta Part A 70, 394-402, 2008.
MOCZAR, I.; HUSZTHY, P.; MEZEI, A.; KADAR, M.; NYITRAI, J.; TOTH, K. Synthesis and optical characterization of novel azacrown ethers containing na acridinone or an N-methylacridinone unit as potential fluorescent chemosensors. Tetrahedron 66, 350-358, 2010.
WEEKS, I.; BEHESHTI, I; McCAPRA, F.; CAMPBELL, A.K.; WOODHEAD, S. Acridinium Esters as High-Specific-Activity Labels in Immunoassay. Clinical Chemistry, vol. 29, Nº 8, 1983.
