ÁREA: Bioquímica e Biotecnologia
TÍTULO: Ultrafiltração de beta-galactosidase: viabilidade de processo
AUTORES: Molon, F.O. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Fagundes, A.S. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Alvares, G.T. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Lemes, A.C. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Di Luccio, M. (UNIVERSIDADE FEDERAL DE SANTA CATARINA) ; Kalil, S.J. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
RESUMO: O objetivo deste trabalho foi verificar a eficiência da ultrafiltração (UF) na concentração e purificação da enzima beta-galactosidase, avaliando-se a adsorção e o fluxo de permeado no processo. Os ensaios de UF e adsorção foram realizados a 4°C, pH 6,5, 7,0 e 7,5, utilizando membranas de 100 kDa. A adsorção foi avaliada pela imersão da membrana em extrato enzimático e quantificada pela razão entre a atividade enzimática no controle e atividade na presença da membrana, e o fluxo permeado pela quantificação do volume permeado ao longo do processo. A baixa adsorção enzima/membrana e o fluxo permeado obtido nos diferentes valores de pH, de até 21,0 L/m².h, viabilizam o processo, proporcionando uma concentração de volume superior a 7 vezes e recuperação enzimática de até 106,4%.
PALAVRAS CHAVES: adsorção; fluxo do permeado; ultrafiltração
INTRODUÇÃO: O desenvolvimento dos processos de separação por membranas tem aumentado o interesse na aplicação dos mesmos na concentração e purificação de enzimas (MOURA et al., 2007), porém, fatores limitantes, como a adsorção de proteínas nas membranas, e a queda do fluxo provocado pela polarização da concentração e “fouling”, podem levar à redução da eficiência destes processos (LOPES et al., 2007).
A ultrafiltração está sendo cada vez mais aplicada para a concentração e purificação de biomoléculas em soluções aquosas (PORTER, 1972; CLIFTON et al., 1984) devido a vantagem de operação em larga escala, baixo custo, facilidade de operação (CHERYAN, 1998;. LUQUE et al, 2004), por não requerer aditivos e mudanças de fases, e por ser realizada em baixas pressões e temperaturas, assegurando assim, o mínimo de desnaturação dos bioprodutos que são altamente instáveis. Sendo assim, esta técnica apresenta potencial para ser aplicada na concentração e purificação de beta-galactosidase, uma enzima que catalisa a hidrólise da lactose (GEKAS & LÓPEZ-LEIVA, 1985) e contribui para a formação de galacto-oligosacarídeos, benéficos ao corpo humano (PATEL & MACKENZIE, 1985; FURLAN & SCHNEIDER, 2000).
O objetivo deste trabalho foi verificar a eficiência do processo de UF na concentração e purificação da enzima beta-galactosidase de Kluyveromyces marxianus CCT 7082 utilizando membrana de 100 kDa em diferentes valores de pH (6,5; 7,0 e 7,5).
MATERIAL E MÉTODOS: Produção da enzima e viabilidade da UF:
A enzima foi obtida por cultivo submerso da levedura K. marxianus em agitador rotatório a 30ºC, 180 rpm por 96 h (MANERA et al., 2008) e extraída em agitador tipo vórtex, utilizando 1,1g de pérolas de vidro (0,6 - 0,8 mm) para cada mililitro de suspensão celular (40 mg de célula seca ressuspendidas em tampão fosfato de potássio 50 mM pH 6,6), por 40 min com intervalos de 2 min de repouso em banho de gelo. O extrato bruto clarificado foi obtido por centrifugação da suspensão celular a 4700xg, 10 min, 4ºC (MEDEIROS et al., 2008; MEDEIROS et al., 2012).
A adsorção da enzima foi avaliada em triplicata pela imersão de 25 mm2 de membrana de 100 kDa em 5 mL de extrato enzimático a 4ºC em pH 6,5, 7,0 e 7,5, durante 180 min, sendo quantificada pela razão entre a atividade enzimática do controle sem membrana (Ab) e atividade na presença da membrana (Am). O fluxo foi determinado pelo volume permeado durante o processo em triplicata utilizando célula de UF alimentada com 40 mL de extrato enzimático (atividade enzimática: 24,3 U/mL; atividade específica: 5,0 U/mg) agitado por uma barra magnética para simulação do escoamento em fluxo cruzado, pressão de operação de 1,5 kgf/cm², membrana de 100 kDa, a 4ºC, em pH 6,5, 7,0 e 7,5, por até 80 min (aproximadamente 6 mL de extrato retido). A determinação de proteínas foi realizada segundo metodologia de Bradford (1976) utilizando albumina de soro bovino como padrão, e a atividade enzimática determinada usando o-nitrofenil-β-D-galactopiranosídeo como substrato, a 37ºC, pH 6,6. Uma unidade de atividade enzimática (U) é definida como a quantidade de enzima necessária para liberar 1 μmol de o-nitrofenol por minuto nas condições de ensaio (INCHAURRONDO et al., 1994).
RESULTADOS E DISCUSSÃO: A Figura 1 mostra a adsorção da enzima, onde, independentemente do pH, a atividade enzimática não sofreu grandes alterações, menor que 8%, indicando baixa interação da enzima com a membrana.
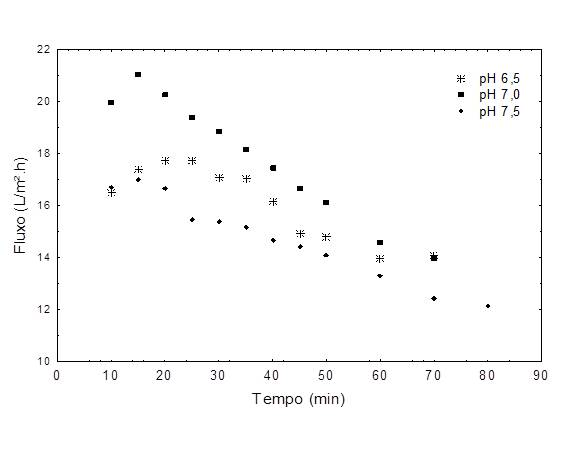
A queda do fluxo observada em todos os valores de pH (Figura 2) é um comportamento típico dos fenômenos de polarização de concentração e de incrustação da membrana. Conforme a solução vai sendo concentrada, o teor de proteínas na superfície da membrana aumenta, aumentando a camada polarizada. Dependendo da situação, pode ocorrer a formação de uma camada gel, que leva a uma maior queda do fluxo (GHOSH & CUI, 2001).
A menor queda de fluxo ocorreu em pH 6,5, variando de 17,7 a 13,9 L/m².h, com redução de 21% e tempo máximo de operação de 70 min. Em pH 7,0 o fluxo médio variou de 21,0 a 13,9 L/m².h, com tempo máximo de operação de 70 min. Embora tenha apresentado o maior fluxo inicial, verificou-se uma maior redução durante o processo (36,5%), que pode ser resultante da aglomeração de proteínas na membrana (PALECEK et al., 1993) que altera o funcionamento da membrana original (SAHA et al., 2003). Em pH 7,5 o fluxo médio de permeado variou entre 16,9 a 12,1 L/m².h, com redução de 28,4% e tempo máximo de operação de 80 min.
As quedas de fluxo foram similares ou menores as encontradas em processos utilizando membranas de 30, 50 e 60 kDa nos mesmos valores de pH, com tempo de processo de até 125 min (LEMES et al., 2011). Isto demonstra a viabilidade da UF com membrana de 100 kDa, pela baixa interação enzima/membrana e menor variação de fluxo e tempo de processo. Apesar de não ser eficiente para purificação, apenas 1,2 vezes (atividade enzimática: 157,7 U/mL; atividade específica: 5,7 U/mg), proporcionou concentração de volume superior a 7 vezes e recuperação enzimática de até 106,4%.
Figura 1 – Cinética de adsorção da enzima beta-galactosidase
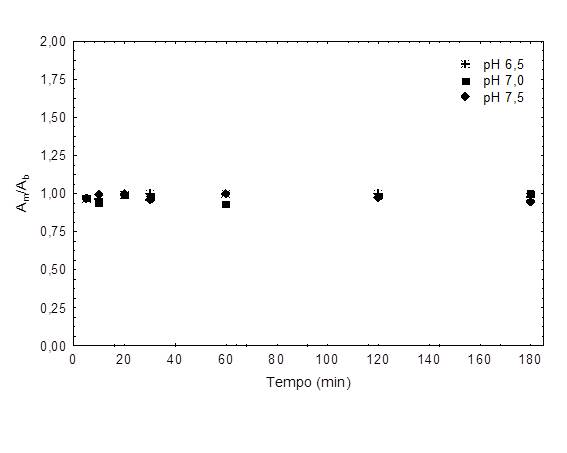
Figura 2 - Fluxo de permeado utilizando membrana de 100kDa
CONCLUSÕES: A concentração da enzima beta-galactosidase por ultrafiltração, utilizando membrana de 100 kDa em diferentes valores de pH, mostrou-se viável, devido a menor redução de fluxo de permeado durante o processo e a baixa adsorção da enzima na membrana. Além disso, proporcionou concentração de volume superior a 7 vezes e recuperação enzimática de até 106,4%, indicando sua aplicação para redução de volume inicial de trabalho em diferentes etapas de uma estratégia de purificação.
AGRADECIMENTOS: À CAPES, CNPq e FAPERGS pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: BRADFORD, M. 1976. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Analytical Biochemistry, 72: 248-254.
CHERYAN, M. 1998. Ultrafiltration and Microfiltration Handbook. Technomic Publishing Co., Lancaster, Pennsylvania, USA.
CLIFTON, M.J; ABIDINE, N; APTEL, P; SANCHEZ, V. 1984. Growth of the polarization layer in ultrafiltration with hollow-fiber membranes. Journal Membrane Science, 21:233-245.
F.O. MEDEIROS, C.A.V. BURKERT, S.J. KALIL. 2012. Purification of b-Galactosidase by Ion Exchange Chromatography: Elution Optimization Using an Experimental Design. Chemical Enginering Technology, 35(5): 911-918.
FURLAN, S; SCHNEIDER, A. 2000. Formulation of a lactose-free, low-cost medium for the production of b-galactosidase by Kluyveromyces marxianus. Biotechnology Letters, 22: 589–593.
GEKAS, V; LÓPEZ-LEIVA, M. 1985. Hydrolysis of lactose: a literature review. Process Biochemistry, 20: 1-12.
GHOSH, R.; CUI, F. F. 2001. Protein purification by UF with pré-treated membrane. J. Memb. Science, 167: 47-53.
INCHAURRONDO, V.A.; FLORES, M.V.; VOGET, G.E. 1998. Growth and β-galactosidase synthesis in aerobic chemostat cultures of Kluyveromyces lactis. J. Industrial Microb. and Biotechn, 20: 291–298.
LEMES, A.C.; MOLON, F.O.; FAGUNDES, A.S.; DI-LUCCIO, M.; KALIL, S.J. 2011. Ultrafiltração de β-galactosidase: Influência do pH e Massa Molar de Corte da Membrana no Processo. SINAFERM : 1-6.
LOPES, F.L.G; SEVERO-JR, J.B; SANTANA, J.C.C; SOUZA, R.R. TAMBOURGI, E.B. 2007. Avaliação de fenômenos redutores de fluxo permeado em microfiltrações de suco de abacaxi. Exacta, 5: 329-334.
LUQUE, S; BENITO, J.M; COCA, J. 2004. The importance of specification sheets for pressure-driven membrane processes. Filtration Separation, 41(1):24–28.
MANERA, A. P.; ORES, J.C.; RIBEIRO, V.A.; BURKERT, C.A.V.; KALIL, S.J. 2008. Optimization of the culture medium for the production of β-galactosidase from Kluyveromices marxianus CCT 7082. Food Technology Biotechnology, 46: 66-72.
MEDEIROS, F. O; ALVES, F. G; LISBOA, C. R; MARTINS, D. S; BURKERT, C. A. V; KALIL, S. J. 2008. Ondas ultrassônicas e pérolas de vidro: um novo método de extração de β-galactosidase para uso em laboratório. Química Nova, 31(2): 336-339.
MOURA, J.M.L.N; RIBEIRO, A.P.B; GRIMALDI, R; GONÇALVES, L.A.G. 2007. Reator de membrana enzimático e fluidos supercríticos: associação de processos. Quimica Nova, 30: 965-969.
PALECEK, S.P.; MOCHIZUKI, S.; ZYDNEY, A.L. 1993. Effect of ionic environment on BSA filtration and the properties of BSA deposits. Desalination, 90: 147–159.
PATEL, G.B; MACKENZIE, C.R. 1985. Properties and potential advantages of β-galactosidase from Bacteroides polypragmatus. Applied Microbiology and Biotechnology, 22: 114–120.
PORTER, M.C. 1972. Concentration polarization with membrane ultrafiltration. Industrial Engineering Chemical Process Research, 11: 234.
SAHA, N.K.; BALAKRISHNAN, M.; ULBRICHT, M. 2006. Polymeric membrane fouling in sugarcane juice ultrafiltration: role of juice polysaccharides. Desalination, 189: 59-70.
