ÁREA: Bioquímica e Biotecnologia
TÍTULO: Produção de enzimas carboidrolíticas por Trichoderma reesei em casca de arroz
AUTORES: Kupski, L. (FURG) ; Silvello, M.A.C. (FURG) ; Fontes, M.R.V. (FURG) ; Lima, T.S. (FURG) ; Garda-buffon, J. (FURG) ; Badiale-furlong, E. (FURG)
RESUMO: A cinética de produção carboidrolitica por Trichoderma reesei QM 9414 durante
fermentação em estado sólido de casca de arroz foi avaliada, obtendo-se atividades
máximas em 55 h de 0,605 U.mgproteína-1, 0,335 U.mgproteína-1 e 0,036
U.mgproteína-1 para endoglucanase, pectinase e amilase, respectivamente. A partir
desses resultados verificamos que esse micro-organismo pode ser empregado para
degradar resíduos da agroindústria de forma sustentável ao propiciar a geração de
enzimas de alto valor agregado e promissor do ponto de vista industrial.
PALAVRAS CHAVES: casca de arroz; enzimas; FES
INTRODUÇÃO: A fermentação em estado sólido (FES) é um processo onde um substrato insolúvel é
fermentado com umidade suficiente, mas sem água livre. O uso da FES como método
de produção de enzimas pode oferecer algumas vantagens em relação à fermentação
submersa, como por exemplo, uma maior concentração do produto e equipamentos
simples para fermentação, bem como baixos requerimentos de agitação, aeração e
geração de efluente durante a produção de enzima. Além disso, esse método
emprega co-produtos agroindustriais na sua forma natural como substrato, como a
casca de arroz, amplamente encontrada na Região Sul do Rio Grande do Sul,
contribuindo assim para a sustentabilidade do agronegócio (CAMASSOLA e DILLON,
2010). Entre as enzimas produzidas por FES, encontram-se as carboidrolases,
destacando-se celulases, amilases e pectinases, que podem ser aplicadas em
diferentes setores industriais, tais como indústrias alimentícias, de ração
animal, têxtil, detergente e cervejeira (SINGANHIA et al., 2010). Estas enzimas
possuem aplicação restrita em processos de larga escala em função da grande
quantidade requerida para a digestão dos subtratos e do seu alto custo de
produção (DAS e GHOSH, 2009). Portanto, a utilização de resíduos de baixo custo
como fonte de carbono ou nitrogênio, é uma alternativa que precisa ser
encontrada a curto prazo para a redução dos custos de produção. Neste trabalho
foi avaliada a cinética de produção enzimática durante FES com Trichoderma
reesei QM 9414, empregando casca de arroz como fonte de carbono.
MATERIAL E MÉTODOS: A FES foi realizada em erlenmeyers contendo casca de arroz como substrato. Estes
foram autoclavados a 121ºC durante 15 minutos e posteriormente suplementados com
solução nutriente contendo (g.L-1): KH2PO4 (20), (NH4)2SO4 (13), CO(NH2)2 (3),
MgSO4.7H2O (3), CaCl2 (3), FeSO4.7H2O (0,05), MnSO4.H2O (0,0156), CoCl2 (0,002),
ZnSO4.7H2O (0,014). A concentração inicial de esporos de Trichoderma reesei
utilizada no processo foi de 4 milhões de esporos a cada grama de substrato,
adicionando-se água estéril para obtenção de um teor de umidade inicial de 50%.
Estes biorreatores foram incubados a 30 ºC durante 75h, com retirada de amostra
a cada 5 horas nas primeiras 25h de processo e após a cada 10h paras
determinações analíticas. A extração enzimática dos fermentados foi realizada
com NaCl 0,5%, proporção 1:5 (p:v) a 25ºC durante 30 minutos. O extrato bruto
obtido foi quantificado quanto ao teor proteico solúvel (LOWRY et al., 1951) e
atividade enzimática de endoglucanase (GHOSE, 1987), pectinase (RODRIGUEZ-
FERNANDEZ, 2009) e amilase (BARAJ et al.,2010). Uma unidade (U) de endoglucanase
e pectinase foi definida como a quantidade de glicose (µmol) e ácido
galacturônico (mg), respectivamente, liberados e a de amilase a quantidade de
amido hidrolisado (mg) por minuto nas condições do ensaio. O acompanhamento da
liberação de açúcares redutores para o meio foi avaliado pelo método do 3,5 DNS
(MILLER, 1959). A multiplicação fúngica foi estimada através da determinação de
glicosamina (AIDOO et al., 1981) e os resultados foram ajustados ao modelo
logístico para determinação dos parâmetros velocidade máxima de crescimento e
tempo da fase lag (HAMIDI-ESFAHANI et al., 2007).
RESULTADOS E DISCUSSÃO: Durante a fermentação ocorreu um aumento da produção enzimática, obtendo-se a
maior atividade em 55h para endoglucanase 0,605 U.mgproteína-1 (15,26
U.gbiomassa seca-1), 0,335 U.mgproteína-1 (8,5 U.gbiomassa seca-1) para
pectinase e 0,036 U.mgproteína-1 (0,9 U.gbiomassa seca-1) para amilase (Figura
1). ZHAO et al. (2010) avaliaram o efeito do pré-tratamento alcalino e com
micro-ondas nos substratos utilizados (farelo de trigo e casca de arroz) na FES
com Trichoderma sp e obtiveram atividade de endoglucanase da ordem de 6
U.gbiomassa seca-1. HEERD et al. (2011) obtiveram para pectinase produzida por
Aspergillus sojae durante FES de farelo de trigo e casca de laranja (7:3) a
atividade de 3,15 U.gbiomassa seca-1. GUANDALINI (2007) avaliou a produção
amilolítica de Metarhizium anisopliae em resíduos amiláceos e obteve uma
produção de 0,2 U.gbiomassa seca-1 para α-amilase da cepa CG 291. Os valores
encontrados na literatura para endoglucanase, pectina e amilase foram 2,5, 2,7
vezes e 4,5 vezes inferiores ao produzido neste trabalho, respectivamente. Os
açúcares liberados pela ação enzimática foram determinados no meio durante o
processo fermentativo, sendo a maior liberação correspondente ao pico de
produção dessas enzimas. De acordo com BON et al. (2008), a produção de enzimas
durante a fermentação pode ou não estar relacionada com o crescimento do micro-
organismo, ocorrendo neste trabalho uma produção não associada ao crescimento de
Trichoderma reesei, pois ocorre produção das carboidrases inclusive na fase
estacionária da fermentação (Figura 2). A velocidade máxima de crescimento foi
µmáx= 0,04h-1, e tempo da fase lag (tl=9,4h), indicando que até 9,4 h o micro-
organismo está se adaptando ao meio utilizado, justificando a menor produção nos
períodos iniciais de fermentação
Figura 1.
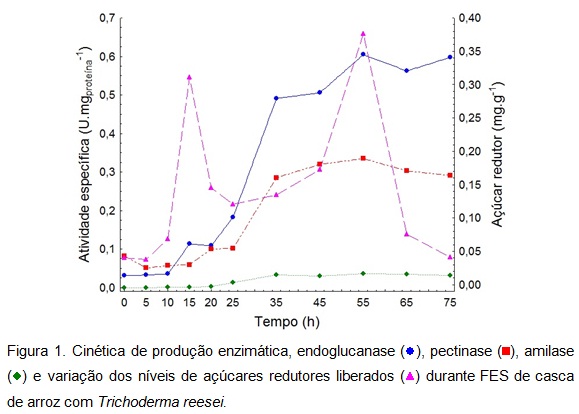
cinética de produção enzimática
FIGURA 2
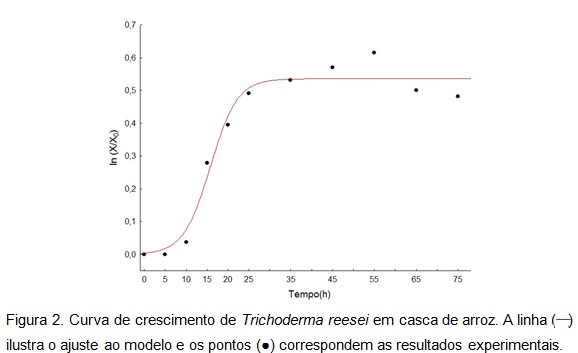
Curva de crescimento durante fermentação
CONCLUSÕES: A produção de enzimas carboidrolíticas em casca de arroz apresentou máxima
atividade celulolítica, pectinolítica e amilolítica em 55h de processo. Portanto a
casca de arroz pode ser empregada para produção de carboidrases para aplicação
industrial para fins de produção de biocompostos ou tratamento de resíduos
sólidos.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: AIDOO, K.E.; HENDRY, R.; WOOD, B.J.B. 1981. Estimation of fungal growth in a solid state fermentation system. Applied Microbiology and Biotechnology, 12: 6-9.
BARAJ, E.; GARDA-BUFFON, J.; BADIALE-FURLONG, E. 2010. Influence of the trichothecenes DON and T-2 toxin in malt aminolitic enzymes activity. Brazilian Journal of Food Technology, 53: 505-511.
BON, E.P.S.; FERRARA, M.A.; CORVO, M. L. 2008. Enzimas em Biotecnologia: Produção, Aplicações e Mercado. Rio de Janeiro: Interciência Brasil, 506p.
CAMASSOLA, M.; DILLON, A.J.P. 2010. Cellulases and Xylanases Production by Penicillium echinulatum Grown on Sugar Cane Bagasse in Solid-State Fermentation. Applied Biochemistry and Biotechnology, 162: 1889-1900.
DAS, A.; GHOSH, U. 2009. Solid-state fermentation of waste cabbage by Penicillium notatum NCIM NO-923 for production and characterization of cellulases. Journal of Science & Industrial Research, 68: 714-718.
GHOSE, T.K.1987. Measurement of cellulose activities. Pure & Applied Chemistry, 59: 257-268,
GUANDALINI, N.C. 2007. Estudo da produção de enzimas amilolíticas pelo fungo Metarhizium anisopliae utilizando resíduos amiláceos como substrato. Dissertação (Engenharia de Alimentos), Unicamp, 94p.
HAMIDI-ESFAHANI, Z.; HEJAZI, P.; SHOJAOSADATI, S.A.; HOOGSCHAGEN, M.; VASHEGHANI-FARAHANI, E.; RINZEMA, A. 2007. A two-phase kinetic model for fungal growth in solid-state cultivation. Biochemical Engineering Journal, 36: 100-107.
HEERD, D.; YEGIN, S.; TARI, C.; FERNANDEZ-LAHORE, M. 2012. Pectinase enzyme-complex production by Aspergillus spp. in solid-state fermentation: A comparative study. Food and Bioproducts Processing, 90: 102-110.
LOWRY, O.H.; ROSENBROUGH, M.J.; FARR, A.L.; RANDALL, R.J. 1951. Protein measurement with the Folin Phenol Reagent. Journal of Biological Chemistry, 193: 265-275.
MILLER, G.L. 1959 Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 31: 426-429.
RODRÍGUEZ-FERNÁNDEZ, D. E. 2009. Desenvolvimento de um bioprocesso por fermentação em estado sólido para produzir e recuperar enzimas de interesse comercial. Tese (Processos Biotecnológicos), Universidade Federal do Paraná, 126p.
SINGHANIA, R. R.; SUKUMARAN, R. K.; PATEL, A. K.; LARROCHE, C.; PANDEY, A. 2010. Advancement and comparative profiles in the production technologies using solid-state and submerged fermentation for microbial cellulases. Enzyme and Microbial Technology, 46: 541-549.
ZHAO, X.; ZHOU, Y.; ZHENG, G.; LIU, D. 2010. Microwave pretreatment of substrates for cellulase production by solid-state fermentation. Apllied Biochemistry and Biotechnology, 160: 1557-1571.
