ÁREA: Bioquímica e Biotecnologia
TÍTULO: DETECÇÃO DA ATIVIDADE ENZIMÁTICA DA ENZIMA LIGNINA PEROXIDASE PRODUZIDA POR FUNGOS FILAMENTOSOS COM POTENCIAL BIOTECNOLÓGICO
AUTORES: Silva, M.G.C. (UFPE) ; Almeida, D.G. (UFPE) ; Maciel, C.C.S.M. (UFPE) ; Miranda, R.C.M.M. (UFS) ; Gusmão, N.B.G. (UFPE)
RESUMO: Este trabalho teve como objetivo detectar a capacidade de fungos filamentosos em
sintetizar a enzima Lignina peroxidase e analisar a atividade da mesma no extrato
obtido. Os 22 micro-organismos utilizados foram isolados do solo do Rio Beberibe-
Recife-PE. Após a análise dos extratos filtrados, 54.4% dos fungos apresentaram
produção da enzima lignina peroxidase acima de 4000U/L. Conclui-se no presente
trabalho que foi possível detectar a presença da enzima Lignina Peroxidase nos
extratos dos fungos pesquisados a valores relativamente altos se comparados com os
da literatura.
PALAVRAS CHAVES: Fungos filamentosos ; Enzimas ligninolíticas; Lignina Peroxidase(LiP)
INTRODUÇÃO: A lignina peroxidase (LiP), comumente isolada de fungos de degradação
branca (podridão branca ou clara) e de degradação parda (podridão
parda), é uma glicoproteína hémica capaz de biotransformar uma variedade de
compostos fenólicos, não fenólicos, hidratos de carbono aromáticos, álcoois
benzílicos e de metila e outros compostos que são resistentes ao ataque
microbiano como também provoca rearranjos intramoleculares (DURÁN & ESPOSITO,
1997; SOARES, 2000). Acredita-se que a lignina peroxidase (LiP) pode ter sido
formada durante a evolução dos fungos degradadores de lignina, promovendo
reações de desaminação de produtos de ácidos aminoaromáticos e posteriormente o
mecanismo extracelular, com a presença da LiP possibilitou a degradação da
lignina (MOREIRA NETO, 2006). O H2O2 primeiramente oxida a enzima e o
intermediário oxidado retira um elétron de núcleos aromáticos, formando radicais
aril, que se decompõem espontaneamente via reação de caráter radicalar
(CARVALHO, 2005). Deste modo, esta enzima pode ser aplicada em processos
biotecnológicos de tratamento de efluentes têxteis, na degradação de
hidrocarbonetos ou resíduos relacionados à lignina (MIRANDA et al., 2012; MACIEL
et al.; 2010; DURÁN & ESPOSITO, 1997). Sendo assim, o presente trabalho teve
como objetivo detectar a habilidade de fungos filamentosos em produzir a enzima
Lignina peroxidase e analisar a atividade da mesma no extrato obtido.
MATERIAL E MÉTODOS: Foram utilizados neste trabalho 22 fungos filamentosos isolados de solo de
diferentes pontos das margens do Rio Beberibe Recife – Pernambuco, os quais
estão mantidos sob refrigeração em Meio Extrato de Malte Agar (MEA) pelo
laboratório de fármacos e ensaios antimicrobianos do Departamento de
Antibióticos da Universidade Federal de Pernambuco.
A fim de observar o potencial para produção da Lignina Peroxidase pelos fungos
isolados, três discos de gelose (6 mm Ø) dos fungos previamente crescidos em
Extrato de Malte Agar (MEA) durante 5 dias foram inoculados em frascos de
Erlenmeyer (250 mL) contendo 50 mL de Solução de Manachini (MANACHINI, FORTINA &
PARINI, 1987) acrescidos de 0,5% de ácido tânico e incubados durante 72 horas a
30°C + 1 em condição estática. Após esse período, as amostras foram filtradas e
cada extrato enzimático foi submetido à análise da atividade da lignina
peroxidase, de acordo com Maciel et al., 2010. A atividade da LiP foi
determinada pela oxidação do álcool veratrílico onde a mistura reativa foi
composta por 1mL de tampão tartarato de sódio (125mM, pH 3.0), 500 µL de álcool
veratrílico (10mM), 500 µL de peróxido de hidrogênio (2mM) e 500 µL de extrato
enzimático. A reação foi iniciada pela adição de peróxido de hidrogênio e o
aparecimento do aldeído veratrílico foi determinado a 310nm (MIRANDA et al.,
2012).
RESULTADOS E DISCUSSÃO: Após a análise dos extratos, 54.5% dos fungos apresentaram produção da enzima
lignina peroxidase (Tabela 1) acima de 4000U/L, tendo como destaque as
atividades apresentadas pelos fungos FDG6B (4988 U/L); FDG11(4994 U/L), FDG08,
FDG20, FDG23 e FDG29 (5000U/L); e FDG 24 (5988
U/L), que alcançou a maior atividade. Maciel et al (2010), trabalhando com fungos filamentosos isolados de local impactado por petroderivados, obtiveram uma atividade máxima para a lignina peroxidase de 144 U/L. Miranda et al (2012), trabalhando também com fungos filamentosos, obtiveram uma atividade máxima para a lignina peroxidase de 111 U/L, quando os fungos foram cultivados em efluente têxtil. Gomes et al. (2009), trabalhando com descoloração de corantes, obtiveram uma atividade enzimática de 9 U/ml para a lignina peroxidase, após cinco semanas de incubação. Já neste trabalho, os fungos estudados apresentaram atividade enzimática acima dos valores comumente relatados pela literatura (Tabela 1), sendo importante uma análise mais detalhada da produção desta enzima por estas linhagens, a fim de caracterizar seu potencial biotecnológico.
Tabela 1 – Atividade da Enzima Lignina Peroxidase pelos fungos estudad
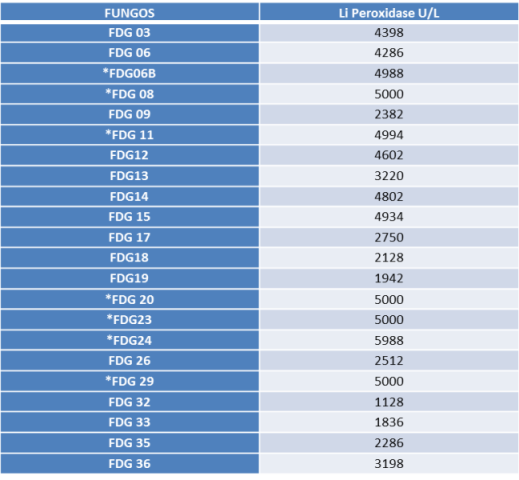
Quantificação da atividade da enzima Lignina Peroxidase para cada fungo, após os procedimentos realizados para a análise dos extratos obtidos
CONCLUSÕES: Deste modo, no presente trabalho foi possível detectar a presença da enzima Lignina Peroxidase nos extratos dos fungos pesquisados a valores relativamente altos se comparados com os da literatura, sugerindo que os fungos em questão são promissores para produção desta enzima, sendo importante um estudo mais detalhado para confirmar seu potencial biotecnológico.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: AGUIAR FILHO, J. M. M. Análise enzimática de fungos lignocelulolíticos cultivados em vinhaça e bagaço de cana-de-açúcar. Dissertação de Mestrado. Escola Superior de Agricultura Luiz de Queiroz, 2008.
DURÁN, N.; ESPOSITO, E. Biodegradação de lignina e tratamento de efluentes por fungos ligninolíticos. In: Melo, I.S.; Azevedo, J. L.; (Eds.). Microbiologia ambiental. Jaguariúna: Embrapa-CNPMA. Documentos. 11:.269-292, 1997.
GOMES, E.; AGUIAR, A. P.; CARVALHO, C. C.; BONFÁ, M. R. B.; SILVA, R.; BOSCOLO, M. Ligninases production by basidiomycetes strains on lignocellulosic agricultural residues and their application in the decolorization of synthetic dyes. Brazilian Journal of microbiology. v. 40, p. 31-39, 2009.
MACIEL, C.C.S.; SOUZA, C.S.; SILVA, R. VILLELA, A.L.S., SOUSA, M.F.V.Q., GUSMAO, N.B. Degradação de querosene de aviação por Penicillium spp. Diálogos & Ciência. V.8, p. 69-75, 2010.
MACIEL, C.C.S.; SOUZA, M.A.; GUSMÃO, N.B.; CAMPOS-TAKAKI, G.M. Produção de enzimas do complexo lignolítico por fungos filamentosos isolados de locais impactados por petroderivados. Exacta. V.8, p. 299-305, 2010.
MANACHINI, P. L.; FORTINA, M. G.; PARINI, C. Purification and properties of an endopolygalacturonase produced by Rhizopus stolonifer. Biotechnology Letters. V.9 (3): 219-224, 1987.
MIRANDA, R. C. M.; GOMES, E. B.; GOUVEIA, E. R.; MACHADO, K. M. G.; GUSMAO, N. B. Decolorization of laundry effluent by filamentous fungi. African Journal of Biotechnology. Vol. 11, p. 4216-4224, 2012.
MOREIRA NETO, S. L. Enzimas Lignolíticas produzidas por Psilocybe castanella CCB444 em solo contaminado com hexaclorobenzeno. Dissertação de mestrado. Instituto de Botânica da Secretaria de Estado do Meio Ambiente, São Paulo, 2006.
SOARES, G. M. B. Aplicação de Sistemas enzimáticos à degradação de corantes têxteis. Tese de Doutorado. Universidade do Minho, 2000.
