ÁREA: Bioquímica e Biotecnologia
TÍTULO: Imobilização de β-galactosidase em Poço A: influência de diferentes parâmetros
AUTORES: Silva, K.H.C. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Silveira, J. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Braga, A.R.C. (UNIVERSIDADE FEDERAL DO RIO GRANDE) ; Silva, M.F. (UNIVERSIDADE REGIONAL INTEGRADA DO ALTO URUGUAI E) ; Treichel, H. (UNIVERSIDADE FEDERAL DA FRONTEIRA SUL) ; Kalil, S.J. (UNIVERSIDADE FEDERAL DO RIO GRANDE)
RESUMO: A enzima β-galactosidase atua na hidrólise da lactose, formando glicose e
galactose, atuando também na obtenção de galacto-oligossacarídeos. O objetivo
desse trabalho foi avaliar a imobilização da enzima β-galactosidase de
Kluyveromyces marxianus CCT 7082, utilizando o suporte Poço A através de um
planejamento experimental completo 24, avaliando a força iônica do
tampão (0,5 a 1,5 mol/L), o tempo de reação (2 a 8 h), a concentração do suporte
(200 a 400 mg) e o pH (6,5 a 7,5) de imobilização. A eficiência de imobilização
variou de 1,6 a 9,1%, sendo a eficiência máxima alcançada quando se utilizou o
tampão fosfato 1,5 mol/L, 8 horas, 400 mg de Poço A e pH 6,5.
PALAVRAS CHAVES: β-galactosidase; imobilização; poço A
INTRODUÇÃO: A β-galactosidase é uma enzima classificada como hidrolase, responsável por
catalisar a conversão da lactose em seus monossacarídeos glicose e galactose
(SANTIAGO et al., 2004). A lactose é um dissacarídeo que possui baixa
solubilidade em água e baixo poder adoçante, além disso, sua cristalização em
produtos lácteos e a restrição ao consumo desses alimentos por pessoas
intolerantes a este açúcar, devido à deficiência de β-galactosidases,podem ser
evitadas através de dois processos de hidrólise enzimática ou ácida, sendo a
enzimática mais utilizada na indústria de laticínios (ALESSI et al.,
2003). A enzima β-galactosidase vem ganhando grande importância por sua
atividade de transgalactosilação da galactose a partir de substratos ricos em
lactose, obtendo-se os galacto-oligossacarídeos (GOS), que atuam como alimentos
prebióticos (MARTINS e BURKERT, 2009). A imobilização de enzimas é um método que
permite superar as limitações de tais proteínas livres, como instabilidade de
suas estruturas e o fato de algumas enzimas operarem dissolvidas em sistemas
homogêneos podendo contaminar o produto, portanto não podendo ser recuperadas em
sua forma ativa para utilização posterior (KLEIN, 2010). O objetivo desse
trabalho foi avaliar a imobilização da enzima β-galactosidase de
Kluyveromyces marxianus CCT 7082, utilizando o suporte Poço A.
MATERIAL E MÉTODOS: Micro-organismo: O micro-organismo utilizado foi Kluyveromyces marxianus
CCT 7082 previamente selecionado por Manera et al (2008) como bom
produtor da enzima β-galactosidase. Produção e extração da enzima β-
galactosidase: A enzima β-galactosidase foi obtida através de cultivo submerso
em frascos agitados contendo 150 mL de meio de cultura (MANERA et al.,
2008). Para extração da enzima β-galactosidase, as células foram rompidas de
acordo com Medeiros et al (2008). Purificação da enzima β-galactosidase:
A enzima foi purificada através da precipitação com adição de sulfato de amônio
ao caldo contendo a enzima, até atingir 70% de saturação de acordo com Heidtmann
et al (2012). Imobilização da enzima: A enzima parcialmente purificada
foi imobilizada com o suporte Poço A. Um planejamento experimental 24
com 16 ensaios e 4 pontos centrais foi realizado onde, concentração de suporte
(200 a 400 mg), concentração do tampão (0,5 a 1,5 mol/L), pH de reação (6,5 a
7,5) e o tempo de reação (2 a 8 h) foram variados. Como reposta obteve-se a
eficiência de imobilização. O volume de enzima utilizado foi de 1,67 mL em 8,33
mL de tampão e a quantidade de suporte variou com cada ensaio. Determinação da
atividade enzimática: A atividade enzimática foi determinada pela reação do
substrato o-nitrofenil-β-D-galactopiranosídeo (ONPG) de acordo com a metodologia
proposta por Inchaurrondo et al.(1994).
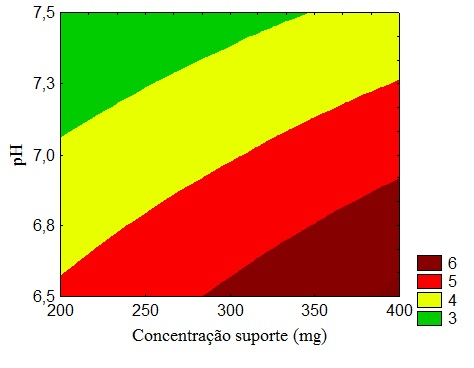
RESULTADOS E DISCUSSÃO: Através da Tabela 1 foi possível observar que a eficiência de imobilização
variou de 1,6 a 9,1%. O melhor ensaio entre os estudados foi o ensaio 12, que
apresentou a maior concentração de suporte (400 mg), a maior força iônica, ou
seja, a maior concentração de tampão (1,5 mol/L), o menor pH (6,5) e o maior
tempo de reação correspondente a 8 h. A partir de uma análise de variância
(ANOVA) foi possível gerar um modelo que representa os ensaios realizados da
imobilização da β-galactosidase por Kluyveromyces marxianus CCT 7082. As
variáveis de maior efeito na eficiência de imobilização foram a concentração de
suporte e o pH nos quais estão representados na superfície de contorno
construída (Figura 1). Ao analisar trabalhos anteriores, sobre a imobilização da
β-galactosidase em Eupergit® C (Braga et al., 2012), pôde-se observar que
para obtenção de melhores resultados os autores mantiveram o pH e concentração
de tampão em maiores níveis, enquanto que em suporte Poço A, a concentração de
tampão e o pH são mantidos em menores níveis. O tempo de reação consiste em uma
variável que também difere para os suportes, enquanto que em Poço A os melhores
resultados são obtidos com maiores tempos de reação, em Eupergit® C são com
menores. A literatura não apresenta dados sobre a imobilização da enzima em
estudo no suporte Poço A, sendo, portanto, os resultados aqui resultados
preliminares para futuros estudos.
Tabela 1.Matriz do Planejamento para imobilização de β-galactosidase
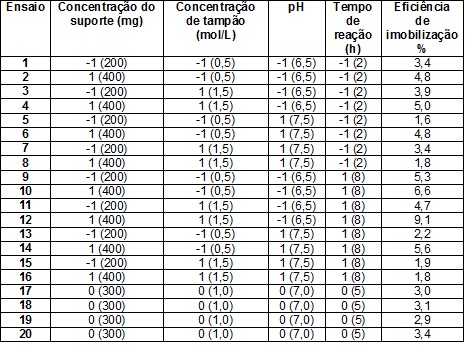
Figura 1.Superfície de contorno para imobilização de β-galactosidase
CONCLUSÕES: A maximização para a imobilização da β-galactosidase teve sua condição
estabelecida como sendo a maior concentração de suporte (400 mg), a menor força
iônica, ou seja, a menor concentração de tampão (0,5 mol/L), o menor pH (6,5) e o
maior tempo de reação (8 h). Nessas condições, obteve-se a eficiência de
imobilização máxima de 9,1 %.
AGRADECIMENTOS: Ao apoio financeiro das entidades: Fapergs, CAPES e CNPq.
REFERÊNCIAS BIBLIOGRÁFICA: ALESSI, M. C. M.; TOMÁS, C. M.; ARAÚJO, E. H.; RIBEIRO, E. J. Discriminação de modelos cinéticos na hidrólise enzimática de lactose. XIV Simpósio Nacional de Fermentações (SINAFERM), 2003, Florianópolis/SC. BRAGA, A. R. C.; SILVA, K. C.; SILVEIRA, J.; SILVA, M. F.; OLIVEIRA, J.V.; TREICHEL, H.; KALIL, S. J. Imobilização de β-galactosidase em Eupergit: influência de diferentes parâmetros. XIX Congresso Brasileiro de Engenharia Química (COBEQ), 2012, Búzios/RJ. HEIDTMANN, R. B.; DUARTE, S. H.; PEREIRA, L. P.; BRAGA, A. R. C.; KALIL, S. J. Caracterização cinética e termodinâmica de ß-galactosidase de Kluyveromyces marxianus CCT 7082 fracionada com sulfato de amônio. Brazilian Journal of Food Techenology, v.15, p.1-9, 2012. INCHAURRONDO, V.A.; YAUTORNO, O.M.; VOGET, C.E. Yeast growth and β-galactosidase production during Aerobic batch cultures in lactose-limited synthetic medium. Process Biochem., v.29, p.47-54, 1994. KLEIN, M. P. Imobilização de β-galactosidase para obtenção de produtos lácteos com baixo teor de lactose. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos). Universidade Federal do Rio Grande do Sul, Porto Alegre, 2010. MANERA, A. P.; ORES, J. C.; RIBEIRO, V. A.; BURKERT, C. A. V.; KALIL, S. J. Optimization of the culture medium for the production of β-galactosidase from Kluyveromyces marxianus CCT 7082. Food Technol. Biotechnol, v.46, p.66-72, 2008. MARTINS, A. R. e BURKERT, C. A. V. Galacto-oligossacarídeos (GOS) e seus efeitos prebióticos e bifidogênicos. Brazilian Journal of Food Techenology, v.12, p.230-240, 2009. MEDEIROS, F.O.; ALVES, F.G.; LISBOA, C.R.; DE SOUZA MARTINS, D.; BURKERT, C.A.V.; KALIL, S.J. Ultrasonic waves and glass pearls: A new method of extraction of beta-galactosidase for use in laboratory. Quim. Nova, v.31, p.336-339, 2008. SANTIAGO, P. A.; MARQUEZ, L. D. S.; CARDOSO, V. L.; RIBEIRO, E. J. Estudo do produto de beta-galactosidase por fermentação de soro de queijo com Kluyveromyces marxianus. Ciência e Tecnologia de Alimentos, v.24, p.567-572, 2004.
