ÁREA: Iniciação Científica
TÍTULO: UM ESTUDO AB INITIO SOBRE AS PROPRIEDADES MOLECULARES DOS COMPLEXOS N2O···HF e ON2···HF
AUTORES: Belarmino, M.K.L. (UFPE) ; Santos, V.F.C. (UFPE) ; Oliveira, M.S.S. (UFPE) ; Lima, N.B. (UFPE)
RESUMO: Neste trabalho, nós empregamos cálculos ab initio para interpretar as propriedades energéticas, eletrônicas, estruturais e vibracionais de dois possíveis complexos de hidrogênio envolvendo N2O•••HF. Os nossos resultados mostraram que a formação da ligação de hidrogênio resulta em mudanças significativas nas propriedades energéticas, eletrônicas e vibracionais tanto de N2O quanto do HF. Dentre essas propriedades, a intensidade do oscilador H-F é aumentada, devido à formação da ligação de hidrogênio e que a frequência de estiramento do HF é deslocada para menores valores.
PALAVRAS CHAVES: Ligação de hidrogênio; óxido nitroso; frequência vibracional
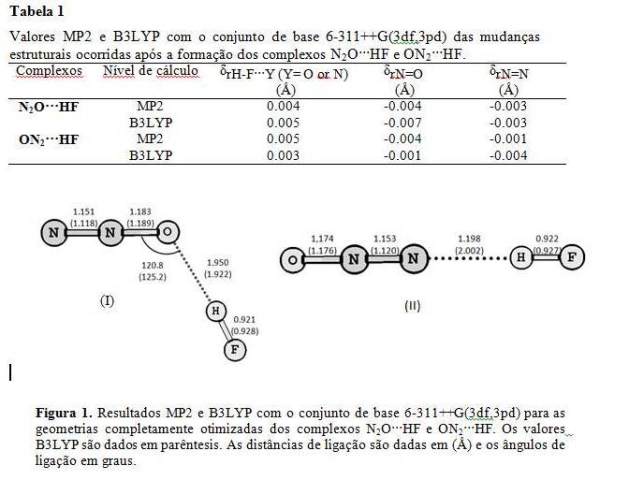
INTRODUÇÃO: É bem conhecido que N2O pode atuar como receptor de hidrogênio ácido, especialmente oriundos de ácidos monopróticos lineares H-X (X= F, Cl, Br, CN e CCH)1. As estruturas desses complexos têm sido determinadas a partir de suas constantes rotacionais. O complexo N2O•••HF pode, por sua vez, apresentar duas estruturas moleculares: uma linear (II) ligando-se através do nitrogênio, e outra, de estrutura angular (I) com o átomo de oxigênio formando a ligação-H, sendo a primeira prevista computacionalmente como sendo ligeiramente mais estável. Entretanto, estudos experimentais revelam que a estrutura (I) é mais estável que a linear (Figura 1). Nosso objetivo foi empregar cálculos ab initio para interpretar as propriedades energéticas, eletrônicas, estruturais e vibracionais desses dois possíveis complexos de hidrogênio de N2O•••HF.
MATERIAL E MÉTODOS: Neste estudo, nós empregamos cálculos de orbitais moleculares usando a teoria de perturbação Møller-Plesset de segunda ordem (MP2)[2] e a teoria do funcional de densidade (DFT)[3] com o funcional B3LYP[4] com o conjunto de funções de base 6-311++G(3df,3pd).
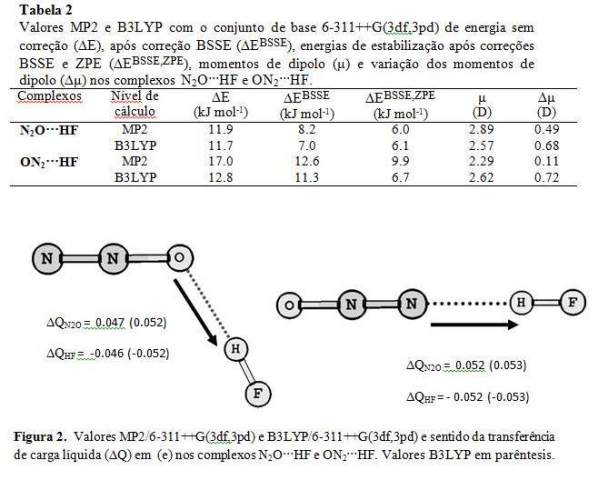
RESULTADOS E DISCUSSÃO: A Tabela 1 mostra as modificações estruturais nos complexos de hidrogênio N2O···HF e ON2···HF, cujas geometrias completamente otimizadas destes complexos de hidrogênio estão descritas na Figura 1. Para os dois complexos o comprimento da ligação H-F aumenta após a formação da LH, enquanto os estiramentos N=N e N=O são encurtados. Estes efeitos acontecem, porque a transferência de carga ocorre no sentido do par isolado envolvido na LH, seja, pelo oxigênio ou pelo nitrogênio terminal, para o orbital antiligante da molécula HF. Este sentido de transferência de carga, faz com que a ligação H-F enfraqueça, ocorrendo assim, um aumento no tamanho do comprimento de ligação. Quando a LH acontece no oxigênio da molécula N2O, um complexo angular é formado, enquanto, ao ocorrer a LH no nitrogênio terminal da molécula N2O, um complexo linear é formado. Isto acontece devido à posição dos pares de elétrons nestes átomos. De maneira geral, quanto menor for o tamanho da LH, mais estável energeticamente é o sistema, então, a principio, esperaríamos que o complexo angular seria mais estável energeticamente comparando com o linear. Fato já confirmado experimentalmente. Entretanto, nossos cálculos mostram que o complexo linear (ON2···HF) é ligeiramente mais estável, comparando com o angular (N2O···HF ). Como mostra a tabela 2. Embora os cálculos computacionais não tenham concordado com os resultados experimentais neste sentido, eles concordam na existência de dois mínimos de potencial, mostrando assim uma possível coexistência em equilíbrio químico destas duas espécies. Os valores de momento de dipolo são determinados essencialmente pela molécula HF, uma vez que o momento de dipolo da molécula N2O é praticamente nulo (0.45 D e 0.06 D para MP2 e B3LYP respectivamente.
CONCLUSÕES: Os nossos resultados mostram que a formação da ligação de hidrogênio resulta em mudanças significativas nas propriedades energéticas, eletrônicas e vibracionais tanto de N2O quanto do HF. Dentre essas propriedades, a intensidade do oscilador H-F é aumentada, devido à formação da ligação de hidrogênio e que a frequência de estiramento do HF é deslocada para menores valores.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ, FACEPE e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Solimannejad M., Alkorta I. e Elguero J., J. Phys. Chem. A, 2007, 111, 2077-2083.
[2] C. Møller, and M.S. Plesset, Phys. Rev. 1934, 46, 618.
[3] A.D. Becke, J. Chem. Phys. 1993, 98, 5648.
[4] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev. 2003, 103,1793.
