ÁREA: Iniciação Científica
TÍTULO: UM ESTUDO TEÓRICO DAS PROPRIEDADES VIBRACIONAIS DOS COMPLEXOS ENVOLVENDO FENANTROLINA E RCOOH (R=-H, -CH3 e –C6H5)
AUTORES: Santos, V.F.C. (UFPE) ; Belarmino, M.K.L. (UFPE) ; Oliveira, M.S.S. (UFPE) ; Lima, N.B. (UFPE)
RESUMO: Nesse trabalho estamos interessados em compreender como a mono complexação na fenantrolina com diferentes ácidos carboxílicos (RCOOH (R= -H e -CH3) podem afetar as propriedades vibracionais tanto do ácido quanto da fenantrolina. Nossos cálculos mostraram que os complexos envolvendo fenantrolina e RCOOH (R= -H, -CH3 e -C6H5) correspondem a pontos de mínimo na curva de potencial. Em particular, as frequências do estiramento O-H deslocam para menores valores e suas respectivas intensidades são consideravelmente aumentadas.
PALAVRAS CHAVES: Ligação de hidrogênio; fenantrolina; ácidos carboxílicos
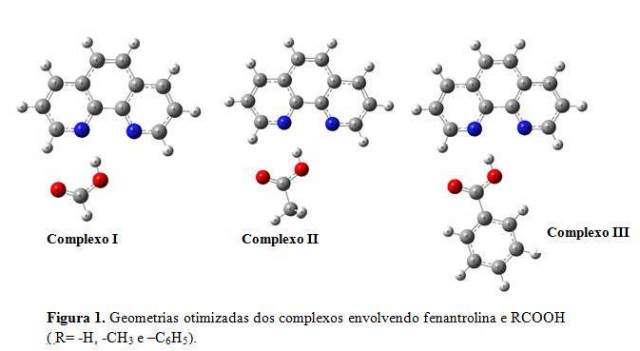
INTRODUÇÃO: É bem conhecido que moléculas nitrogenadas podem formar complexos estáveis de ligação de hidrogênio[1,2]. Estes estudos têm revelado que as moléculas nitrogenadas ao interagir com ácidos lineares monopróticos e ácidos carboxílicos nas proporções 1:1 e 1:2, além de formar complexos estáveis, tanto a mono quanto a dupla complexação resultam em mudanças significativas nas propriedades espectroscópicas da molécula nitrogenada e dos ácidos. Nesse sentido, nós estamos agora interessados em compreender como a mono complexação na fenantrolina (Figura 1) com diferentes ácidos carboxílicos (RCOOH (R= -H e -CH3) podem afetar as propriedades vibracionais tanto do ácido quanto da fenantrolina. Para isto, realizamos cálculos computacionais para obter as mudanças nas propriedades vibracionais que ocorrem nas moléculas isoladas após a complexação.
MATERIAL E MÉTODOS: Para realizar esse estudo, nós empregamos cálculos de orbitais moleculares usando a teoria do funcional de densidade (DFT)[3] com o funcional B3LYP[4] com o conjunto de funções base 6-31++G(d,p). O Programa computacional usado foi o GAUSSIAN 03.
RESULTADOS E DISCUSSÃO: Na Figura 1 mostramos as estruturas otimizadas dos complexos para os sistemas formados entre fenantrolina e RCOOH ( R= -H, –CH3 e –C6H5), na proporção 1:1. É interessante verificar que a formação da ligação de hidrogênio, produz um importante deslocamento para baixo na frequência do estiramento OH e um aumento acentuado em sua intensidade no infravermelho como mostra a tabela 1. Este fenômeno pode ser explicado, pelo fato da ligação de hidrogênio ser formada através de uma transferência de carga no sentido par de elétron isolado do nitrogênio da fenantrolina para o orbital lumo do ácido. Esta transferência de carga, resulta em mudanças nas propriedades vibracionais de todos os envolvidos, sendo estas mudanças mais acentuadas nos estiramentos de ligação mais próximos da ligação de hidrogênio. Para os sistemas envolvendo fenantrolina e os ácidos carboxílicos RCOOH (R=-H e –CH3), verificamos que a formação da ligação de hidrogênio resulta em dois tipos de frequência para o estiramento OH. O primeiro está relacionado com o movimento simétrico e o segundo relacionado com o movimento assimétrico. Estes dois tipos de frequência, indicam o surgimento de um novo modo vibracional dos ácidos. É importante ressaltar que analisando as moléculas dos ácidos livres, ou seja, sem interagir com a fenantrolina, apenas um modo vibracional é observado. Em relação ao complexo envolvendo RCOOH (R= -Ph), apenas um modo vibracional é observado. Nenhuma frequência negativa foi obtida nos cálculos, isto indica que as estruturas encontradas correspondem a pontos de mínimo na curva de potencial.

CONCLUSÕES: Nossos cálculos mostram que os complexos envolvendo fenantrolina e RCOOH (R= -H, -CH3 e -C6H5) correspondem a pontos de mínimo na curva de potencial. Em particular, as frequências do estiramento O-H deslocam para menores valores e suas respectivas intensidades são consideravelmente aumentadas.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Rusu, Victor H. ; Ramos, Mozart N. ; Da Silva, João Bosco P., International Journal of Quantum Chemistry, (2006), 106, 2811.
[2] Nascimento, Renata X. D., Belarmino, Márcia K. D. L., Lima, Nathália B. D., International Journal of Quantum Chemistry,(2012), DOI: 10.1002/qua.24091
[3] A.D. Becke, J. Chem., Phy., (1993), 98, 5648.
[4] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev., (2003), 103, 1793.
