ÁREA: Iniciação Científica
TÍTULO: UM ESTUDO AB INITIO DAS PROPRIEDADES MOLECULARES DOS COMPLEXOS DE HIDROGÊNIO ENVOLVENDO DIMETILSULFÓXIDO E HX (X= F, Cl E CN)
AUTORES: Santos, V.F.C. (UFPE) ; Belarmino, M.K.L. (UFPE) ; Oliveira, M.S.S. (UFPE) ; Lima, N.B. (UFPE)
RESUMO: Neste trabalho estamos interessados em compreender como a formação da ligação de hidrogênio afeta as propriedades eletrônicas, energéticas, estruturais e vibracionais dos complexos envolvendo dimetil sulfóxido (DMSO) e HX (X= F, Cl e CN).Os nossos resultados mostraram que a formação da ligação de hidrogênio resultou em mudanças significativas nas propriedades energéticas, eletrônicas e vibracionais tanto de DMSO quanto do ácido linear monoprótico HX (X= F, Cl e CN).
PALAVRAS CHAVES: Ligação de hidrogênio; dimetilsulfóxido; frequência vibracional
INTRODUÇÃO: É bem conhecido que uma ligação de hidrogênio consiste na presença de um hidrogênio ácido, ou isótopo, ligado entre dois átomos. Estes átomos são, em geral, o oxigênio, nitrogênio ou flúor. Também é conhecido que a formação da ligação de hidrogênio ocasiona uma série de mudanças nas propriedades energéticas, estruturais e espectroscópicas das moléculas envolvidas neste processo[1]. Neste trabalho estamos interessados em compreender como a formação da ligação de hidrogênio afeta as propriedades eletrônicas, energéticas, estruturais e vibracionais dos complexos envolvendo dimetil sulfóxido (DMSO) e HX (X= F, Cl e CN). Para isto, realizamos cálculos computacionais, os quais são capazes de descrever bem as propriedades de interesse.
MATERIAL E MÉTODOS: Neste estudo, nós empregamos cálculos de orbitais moleculares usando a teoria de perturbação Møller-Plesset de segunda ordem (MP2)[2] e a teoria do funcional de densidade (DFT)[3] com o funcional B3LYP[4] com o conjunto de funções base 6-31++G(d,p).
RESULTADOS E DISCUSSÃO: Na figura 1 mostramos as geometrias totalmente otimizadas dos complexos para os sistemas formados entre DMSO e HX ( X= F, Cl e CN). Através da tabela 1 é possível observar que as ligações de hidrogênios formadas pela interação do DMSO com os ácidos lineares HX do ponto de vista computacional são consideravelmente fortes. Sendo os maiores valores observados para os complexos envolvendo HF. Isto já era esperado, uma vez que o F é mais eletronegativo que Cl e CN. A tabela 2 apresenta os valores das mudanças estruturais mais relevantes para os sistemas em questão. Analisando a tabela 2 vemos que o comprimento das ligações H-X e S=O são aumentadas após a formação da ligação de hidrogênio. Entretanto a ligação S-CH3 parece sofrer uma diminuição do seu comprimento. Acreditamos que a transferência de carga eletrônica no sentido par de elétrons isolado do oxigênio → orbital lumo dos ácidos HX envolvida no processo de formação da ligação de hidrogênio ocasiona estes dois fenômenos. Também é importante ressaltar que ao haver um aumento no comprimento da ligação isto provavelmente foi ocasionado pelo enfraquecimento desta ligação. Obsevamos que as frequências vibracionais do oscilador H-X caem para menores valores em todos os casos. Entretanto, se analisamos da razão das intensidades destes complexos pelas intensidades das moléculas livres, ou seja, sem complexar, verificamos que a intensidade dos complexos pode ser 10 vezes maior que a da molécula livre. Estes dois fenômenos também podem ser explicados analisando o sentido da transferência de carga envolvida no processo de formação da ligação de hidrogênio. As mudanças nas propriedades de frequência se revelaram mais acentuadas quando o DMSO interage com o ácido HF.
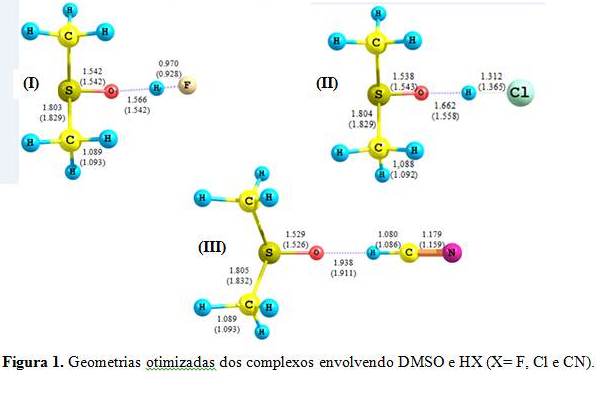
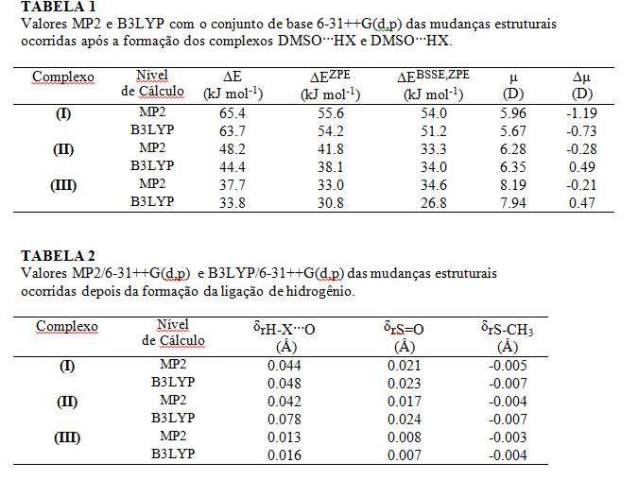
CONCLUSÕES: Os nossos resultados mostram que a formação da ligação de hidrogênio resulta em mudanças significativas nas propriedades energéticas, eletrônicas e vibracionais tanto de DMSO quanto do ácido linear monoprótico HX (X= F, Cl e CN). É importante ressaltar que dentre essas propriedades, a intensidade do oscilador H-X é aumentada, devido à formação da ligação de hidrogênio. Entretanto, a frequência de estiramento do oscilador HX é deslocada para menores valores.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ, FACEPE e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Nascimento, Renata X. D., Belarmino, Márcia K. D. L., Lima, Nathália B. D., International Journal of Quantum Chemistry,(2012), DOI: 10.1002/qua.24091
[2] C. Møller, and M.S. Plesset, Phys. Rev. (1934), 46, 618.
[3] A.D. Becke, J. Chem. Phys. (1993), 98, 5648.
[4] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev., (2003), 103,1793.
