ÁREA: FEPROQUIM - Feira de Projetos de Química
TÍTULO: O estudo da oxidação e recuperação de objetos de prata: O Desconhecimento geral da população.
AUTORES: Castro, J. (COLÉGIO LUMIÈRE) ; Palumbo, M. (COLÉGIO LUMIÈRE) ; Pedroso, L. (COLÉGIO LUMIÈRE) ; Nakayama, C. (COLÉGIO LUMIÈRE) ; Melo, T. (COLÉGIO LUMIÈRE) ; Esidio, L. (COLÉGIO LUMIÈRE)
RESUMO: A prata é utilizada em jóias e talheres e existe um desconhecimento por parte das
pessoas do porquê da prata escurecer e como recuperar esta prata “perdida”. A
prata escurece pela perda de elétrons e combinação com sulfetos e óxidos de
enxofre que estão presentes no ar. A cor escura é proveniente do composto
Ag2S(1). Os meios populares de limpeza envolvem métodos abrasivos, onde
se perde íons prata. O modo mais eficiente de recuperar a prata é reduzindo o íon
prata do objeto, colocando o mesmo numa solução de água e sal de cozinha em
fervura em contato com alumínio metálico, assim, com a oxidação do alumínio
metálico os elétrons que a prata perdeu são recuperados, voltando a ser
Ag0, metálica.
PALAVRAS CHAVES: oxido-redução; sulfeto de prata; prata
INTRODUÇÃO: A descoberta da prata remota à Pré-História, sendo importante na produção de
jóias, espelhos, talheres, e muitos outros objetos. Na natureza, pode ser obtida
no estado puro ou como sal e, também pode ser recuperada como subproduto da
purificação dos metais cobre, níquel e chumbo (2).
A prata (Ag0) é considerada um metal nobre, com potencial de redução
(E0) de +0,799V, portanto apresenta tendência a se manter na forma
reduzida, porém quando exposta ao ambiente, em particular a oxigênio do ar, ela
sofre oxidação a nox +1, perdendo elétrons e, da combinação com os íons sulfeto,
acaba escurecendo. Esta reação ocorre com maior velocidade se o meio estiver
ácido, portanto pessoas com excesso de acidez no suor aceleram a oxidação do
metal. (3)
O método de recuperação da prata consiste da redução dos cátions prata, sem a
retirada da camada oxidada, mantendo-se praticamente constante a quantidade de
prata inicialmente contida no objeto, sem um custo elevado, e utilizando apenas
água, sal e alumínio, pode-se fazer a prata recuperar os elétrons perdidos para
o ambiente, e a tornando prata metálica novamente (Ag0).
O objetivo deste projeto é descobrir e identificar o motivo do escurecimento de
objetos de prata, e a melhor forma de se recuperar a prata, tornando-a metálica
(Ag0) novamente.
MATERIAL E MÉTODOS: Os materiais utilizados para escurecer e recuperar a prata são:
- objeto contendo prata
- papel alumínio ou panela de alumínio
- 4 ovos
- detergente
- colher
- tela de amianto e tripé
- lenços de papel
- béquer
- bico de Bunsen
- Cloreto de sódio (NaCl, sal de cozinha)
- água (H2O)
- 2 copos
Procedimento
O projeto está dividido em duas partes: escurecer a prata, e em seguida, a
limpeza, recuperando-a.
Escurecimento:
1) Colocar água no béquer para cozinhar os ovos;
2) Após os ovos estarem cozidos, rachar a casca deixando a clara exposta;
3) Coloque o objeto no interior do ovo deixando cozinhar por 30 minutos;
4) Retirar o objeto, lavar com água e observar o resultado.
Recuperação:
1) Lavar bem o objeto com detergente
2) Ferver 300mL de água;
3) Misturar uma colher de sal de cozinha (NaCl) na água;
4) Forrar o copo com o alumínio ou utilizar a panela;
5) Colocar a solução de água e NaCl no copo;
6) Colocar o objeto e esperar 4 minutos;
7) Retire o objeto e lave com água;
8) Secar e observar o resultado.
RESULTADOS E DISCUSSÃO: É comum entre as pessoas desconhecer os métodos mais eficientes para a limpeza
de prata, a maioria das pessoas utiliza métodos abrasivos, que desgastam as
camadas externas de prata. Para ilustrar o desconhecimento por parte das pessoas
sobre a limpeza de prata elaborou-se um questionário abordando os principais e
mais citados meios para limpeza da prata. Uma lista contendo as seguintes
perguntas foi apresentada às pessoas, que apontaram o método mais conhecido por
elas para o beneficiamento da prata oxidada:
a) Redução em panela de alumínio
b) Esfregar com flanela
c) Lavar com vinagre
d) Passar batom escuro
e) Lavar com coca-cola
f) Passar sabão de coco
g) Queimar no fogo
h) Passar limão
i) Lavar no sabão em pó com água em fervura
j) Passar pasta de dente
k) Limpa pratas
A maior parte deles envolve a abrasão das camadas externas deixando livre a
camada interna da amostra. Neste processo, perde-se prata por este desgaste.
O processo de escurecimento da prata ocorre naturalmente, quando a prata perde
elétrons, formando sulfeto de prata (S-2). Quanto maior a temperatura
e a concentração dos sulfetos, maior a velocidade da reação. Foi o que ocorreu
na oxidação (escurecimento) quando o cozimento do objeto inserido no interior da
clara do ovo. Neste processo a cisteína se transforma em ácido pirúvico,
liberando H2S que enegrece o objeto de prata.
Tabela pesquisa métodos populares.
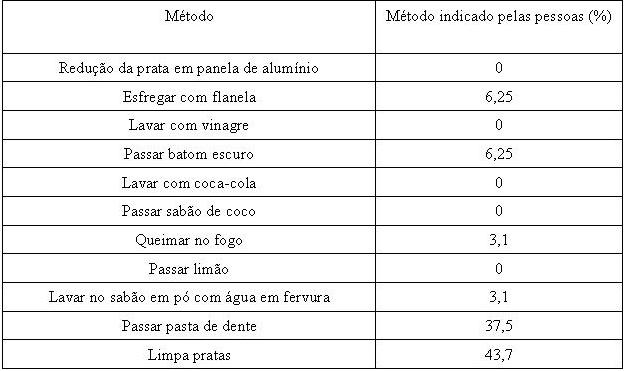
Pesquisa realizada com a comunidade da escola a
respeito da limpeza de objetos de prata, pelos meios
popularmente conhecidos.
Oxidação e Redução de objetos de prata.
A figura está dividida em 3 partes: o escurecimento
dos brincos; a limpeza dos brincos; e uma pulseira
limpa pela metade.
CONCLUSÕES: O escurecimento de um objeto de prata em contato com o sulfeto liberado do
cozimento dos ovos, ocorre de uma forma acelerada, porém é igual a reação natural
quando a prata entra em contato com os gases encontrados no ar. Ao utilizar os
métodos populares de limpeza, ocorre a abrasão e assim a perda de camadas de prata
que estão oxidadas. Para recuperar a prata evitando esta perda, deve-se fazer a
redução dos íons prata provocando uma reação entre o alumínio em contato com a
solução de água e sal de cozinha (NaCl), tornando a prata metálica novamente
(Ag0), e retornando ao brilho original.
AGRADECIMENTOS: Agradecemos nossos pais pelo apoio e dedicação, ao Marcio e a Thalita que nos
incentivaram e guiaram, e ao congresso por nos proporcionar essa oportunidade.
REFERÊNCIAS BIBLIOGRÁFICA: 1. E.R. Sartori, E.F. Batista, O. Fatibello-Filho. Escurecimento de Limpeza de Objetos de Prata – Um Experimento Simples e de Fácil Execução Envolvendo Reações de Óxido-redução. Química Nova na Escola n.30, p. 61-65, São Paulo, 2008.
2. História da prata. Disponível em <http://nautilus.fis.uc.pt/st2.5/scenes-p/elem/e04710.html>. Acesso em 04 julho 2012.
3. LOUREDO, P., Suor. Disponível em <http://www.brasilescola.com/biologia/suor.htm>. Acesso em 04 julho 2012.
