ÁREA: Química Inorgânica
TÍTULO: Avaliação Experimental e Teórica do Desempenho dos Complexos Dimetil bis(2,4-pentanodionato) de Estanho(IV) e Dicloro bis(2,4-pentanodionato) de Estanho(IV) em Reações de Transesterificação e Esterificação de Óleos Vegetais para Obtenção de Biodiesel.
AUTORES: da Silva, M.A. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; dos Santos, T.V. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; de Sena Rosa, C.V.G. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Cardoso, D.A.F. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Meneghetti, S.M.P. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Meneghetti, M.R. (UNIVERSIDADE FEDERAL DE ALAGOAS)
RESUMO: Neste trabalho foi investigado o perfil cinético de dois catalisadores, o
dimetilbis(2,4-pentanodionato) de estanho(IV) – Sn-CH3 e diclorobis(2,4-
pentanodionato) de estanho(IV) – Sn-Cl. Estes compostos foram testados na
alcoólise do óleo de soja para a obtenção de ésteres alquílicos de ácidos graxos.
Nos experimentos de transesterificação do óleo vegetal, as reações foram
realizadas em dois tipos de equipamentos. O primeiro foi um reator de vidro
acoplado a um condensador de refluxo e o segundo foi composto de um reator de aço
inox pressurizado. As reações foram realizadas nas temperaturas de 80°C, 120ºC e
150°C, e o tempo reacional variou de 1h, 2h e 4 h. Em seguida, o produto reacional
foi analisado por cromatografia gasosa (CG).
PALAVRAS CHAVES: transesterificação; complexos de estanho (IV); biodiesel
INTRODUÇÃO: Compostos a base de Estanho(IV) foram empregados, industrialmente, por muito
tempo como precursores catalíticos em diversas reações tais como reação de
policondensação e produção de poliuretanas. Devido a sua importante atividade
catalítica, a ampliação de seu uso em catálise, em diversos setores, está sendo
feita. Com a preocupação atual em relação à obtenção de energia a partir de
fontes renováveis, as perspectivas de síntese de novos complexos a base de
Sn(IV) aumentaram, de forma que tais complexos estão sendo exaustivamente
estudados a fim de que tais complexos possam ser empregados de forma
satisfatória nas reações de transesterificação e esterificação para obtenção de
biodiesel. Neste contexto, foi conduzido um estudo teórico acerca da acidez
relativa de complexos dimetilbis(2,4-pentanodionato) de estanho(IV) e
diclorobis(2,4-pentanodionato) de estanho(IV) – a partir de agora referidos como
SnMe e SnCl, respectivamente – numa tentativa de melhor compreender seu
comportamento catalítico.
MATERIAL E MÉTODOS: Dois tipos de reatores foram empregados nos experimentos de transesterificação.
O primeiro foi constituído de um reator de vidro de 50 mL, acoplado a um
condensador de refluxo. O segundo foi um reator de aço inox– RP de 200 mL,
acoplado a um manômetro com medidor de pressão e temperatura.
Nos dois sistemas foram empregadas as razões molares de 400:100:1 (álcool:óleo
vegetal:catalisador). Em todos os experimentos realizados a agitação magnética
empregada foi constante e igual a 1000 rpm. Os tempos de reação variaram de 1 a
4 h.
O produto obtido na metanólise do óleo de soja foi lavado com água destilada e
centrifugado (5 minutos/2500 rpm). Após ser lavada e centrifugada três vezes, a
mistura reacional (fase orgânica) foi transferida para um frasco adequado e
estocada com o agente dessecante sulfato de magnésio anidro. Após esse
tratamento as amostras foram analisadas por cromatografia gasosa (CG).
Alguns cálculos computacionis foram realizados para um melhor entendimento sob o
comportamento dos complexos, e todos os cálculos de otimização de geometria e de
estudo de estrutura eletrônica foram desenvolvidos usando o método Hartree-Fock
(HF), com função LANL2MB, e Teoria do Funcional de Densidade (DFT), com
funcional híbrido B3LYP e função LANL2DZ. Em todos os cálculos, os sistemas
moleculares foram tomados como neutros, com multiplicidade de spin simpleto e em
fase gasosa. Todos os cálculos ab initio e DFT aqui relatados foram
desenvolvidos usando o software Gaussian03.
RESULTADOS E DISCUSSÃO: Os resultados permitem observar que, nas condições reacionais empregadas, o complexo Sn-CH3 exibiu maior atividade que o Sn-Cl. Também é possível observar que, ao se empregar o Sn-CH3 o rendimento em ésteres metílicos aumenta com o aumento do tempo reacional nos dois reatores empregados vê figura 1 (a). Para atingirmos condições mais enérgicas de reação, os dois catalisadores foram testados no reator fechado nas temperaturas de 120 e 150 ºC. O gráfico da Figura 1(b) apresenta os rendimentos em estéres metílicos (%) obtidos.Para uma melhor explicação para tais resultados usufruímos da modelagem quântica, e os cálculos mostram que os ligantes Cl atuam como um sistema π-básico, assistindo eletronicamente o centro metálico através de seus elétrons não-ligantes, o que poderia indicar uma diminuição da acidez relativa se comparado ao complexo com ligantes CH3. Por outro lado, os ligantes metila provocam um enfraquecimento das ligações Sn-O, principalmente nas posições axiais (Figura 2 (a) e 2 (b)). Análise de Orbitais Naturais de Ligação (NBO) revelaram que a ligação Sn-O torna-se mais fraca, no complexo SnCl, devido à transferência de densidade eletrônica (elétrons não-ligantes) do ligante Cl para o orbital σ* da ligação Sn-O. Isso poderia então provocar uma labilização das ligações Sn-O, permitindo um rompimento do sistema quelato, com posterior coordenação dos substratos contendo ligantes carbonila na forma de ésteres.
Por esses motivos, o sistema SnMe deve apresentar uma acidez relativa mais elevada.
Figura 1 (a) e 1(b)
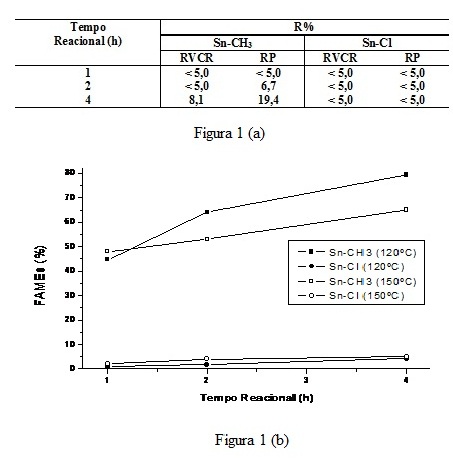
Rendimento em ésteres metílicos (R%) dos catalisadores Sn-CH3 e Sn-Cl, em dois diferentes sistemas reacionais 1(a) e diferentes temperaturas 1(b)
Figura 2
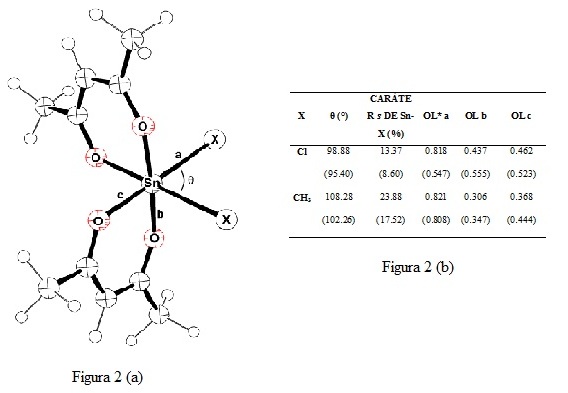
Representação esquemática dos complexos Sn-CH3 e Sn-Cl em ligações e ângulos estudados 2(a)e dados eletrônicos e estruturais dos complexo 2(b)
CONCLUSÕES: As reações realizadas com o reator pressurizado apresentaram rendimentos superiores aos obtidos com o reator de vidro, independentes da temperatura empregada e do tempo reacional.
A influência dos efeitos estéreos e eletrônicos, dos diferentes grupos presentes na estrutura do catalisador foi colocada em evidência.
Esse comportamento foi confirmado com estudos teóricos que demonstraram que efeitos eletrônicos são mais importantes que efeitos estéreos e o catalisador Sn-CH3 é o mais ácido.
Estudos estão em andamento para testar o perfil cinético desses catalisadores em reações de esterificação.
AGRADECIMENTOS: CNPq, CAPES, FINEP, FAPEAL
REFERÊNCIAS BIBLIOGRÁFICA: P. A. Z. Suarez; A. L. F. Santos; J. P. Rodrigues; M. B. Alves; Química Nova. 2009, 32, 768-775.
D.A.C. Ferreira; M.R. Meneghetti; S.M.P. Meneghetti; C.R. Wolf; Appl. Catal. A: General, 2007, 317, 58–61
M. J. Frisch et al., Gaussian 03, Revision C.02, Gaussian, Inc., Wallingford CT, 2004.
C.J. Jones, “A Química dos Elementos dos Blocos d e f”, Bookman, Porto Alegre, 2002, 128-132.
H.A. Bent; J. Chem. Educ. 1960, 37, 616 - 624.
H.A. Bent; Chem. Rev. 1961, 61, 275 - 311.
