ÁREA: Química Inorgânica
TÍTULO: Estudo estrutural e espectroscópico de um dos complexos formados entre o Al(III) e a tirosina em solução aquosa
AUTORES: Tenório, T. (PUC-RIO) ; Ramos, J.M. (UFRJ) ; Buarque, C.D. (PUC-RIO) ; Felcman, J. (PUC-RIO)
RESUMO: O estudo do sistema binário de Al(III) com a tirosina (Tir) foi feito por meio de
espectroscopia Raman em solução aquosa na proporção Al(III):Tir 1:1, de modelagem
molecular e de cálculos teóricos do espectro vibracional através do procedimento
DFT:B3LYP/6-311G. O complexo [Al(Tir)(H2O)4]2+, formado em solução aquosa, foi
investigado. Estas técnicas sugerem que a tirosina comporta-se como ligante
bidentado coordenando-se através dos átomos de oxigênio do grupo carboxilato e de
nitrogênio da amina. Quatro águas estariam presentes na esfera de coordenação do
íon nesta espécie. A modelagem molecular mostrou que a geometria adotada pelo
centro metálico é a octaédrica distorcida.
PALAVRAS CHAVES: Alumínio; Espectroscopia Raman; cálculos DFT
INTRODUÇÃO: O alumínio(III), encontrado ordinariamente no corpo humano, é um íon
metálico ligado a doença de Alzheimer. Este metal relaciona-se a promoção da
agregação de proteína β-amilóide, ao aumento da concentração e da
neurotoxicidade de placas senis (formadas por agregados de proteína β-amilóide)
e a degeneração de neurônios. Além de influenciar a fosforilação da proteína
Tau, o que favorece a formação de emaranhados neurofibrilares, que contém
microtúbulos hiperfosforilados associados à proteína Tau (FERREIRA et al.,
2008).
A tirosina (Tir) é um aminoácido aromático não essencial presente na dieta e no
sangue humano, que possui elevada afinidade pelo Al(III) em comparação com
outros íons (BOHRER et al., 2001).
Além disso, a proteína Aβ é uma metaloproteína que se liga a íons metálicos
através de quatro aminoácidos, um desses uma tirosina, localizada na parte
hidrofílica N-terminal do peptídeo. Estudos revelam que alterações na β-amilóide
como a oxidação que envolve o aminoácido em questão pode modificar a progressão
do Alzheimer (HUANG et al., 1999). A Tir presente tanto na proteína Aβ quanto na
Tau também se relaciona de outras formas ao Alzheimer, ao afetar o
desenvolvimento e a progressão da patologia por meio de sua fosforilação nas
proteínas.
A Tir pode formar complexos com o Al(III) de modo a favorecer sua absorção, e
coordenar-se ao metal no corpo humano, especialmente, no cérebro.
A pesquisa em questão possui como objetivo investigar o modo de coordenação em
solução aquosa do ligante tirosina no complexo [Al(Tir)(H2O)4]2+.
MATERIAL E MÉTODOS: O nitrato de alumínio nonahidratado P.A. (Merck) e a tirosina (Sigma-Aldrich)
foram os reagentes empregados na análise espectroscópica.
O espectrômetro utilizado foi o Raman Station Modelo 400 Perkin Elmer com laser
diodo estabilizado de alta performance em 785 nm (IR-Próximo 785 nm) com
intensidade do sinal-ruído > 40 dB e estabilidade de 0,1 nm.
Os espectros Raman foram obtidos em estado sólido e em solução aquosa para o
ligante Tir e em solução aquosa para o sistema binário Al(III):Tir na proporção
1:1. As análises foram feitas em ambiente escurecido à temperatura de 25°C com
soluções de concentração 0,5 mol.L-1 na faixa de 3500 a 100 cm-1.
A subtração manual do espectro da água e da solução de nitrato de alumínio do
espectro do complexo foi feita. A deconvolução e a segunda derivada do espectro
experimental auxiliaram na análise espectral.
Os cálculos computacionais foram realizados no programa Gaussian 03W (FRISCH et
al., 2003). Empregou-se a teoria do funcional de densidade (DFT), com funções
híbridas B3LYP e a base de Pople 6-311G.
De modo a realizar as correções para os desvios dos números de onda calculados,
seguiu-se a recomendação de multiplicar os valores obtidos teoricamente pelo
fator 0,9613. Usado para obtenção de números de onda mais próximos do espectro
experimental nesta base. O fator é utilizado como uma correção da discrepância
que pode vir a ocorrer entre os números de onda do espectro experimental,
correspondente ao espectro anarmônico, e do espectro calculado, espectro
harmônico.
RESULTADOS E DISCUSSÃO: Segundo a espectroscopia Raman, alguns números de onda característicos e suas
atribuições vibracionais, tabela 1, sugerem que a tirosina atua como ligante
bidentado no complexo [Al(Tir)(H2O)4]2+.
Os átomos doadores são um oxigênio do grupo carboxilato e um nitrogênio do grupo
amino. Quatro águas coordenadas completariam a esfera de coordenação do Al(III).
A potenciometria encontrou o valor de log KAlTyr de 6,20 ± 0,01 (SILVA E
FELCMAN, 2003), e este método também sugere tal modo de coordenação.
A banda ν(C=O) desloca-se para números de onda mais altos no espectro do
complexo se comparado ao do ligante, o que sugere a coordenação pelo grupo
carboxilato. A complexação através dos dois átomos de oxigênios do carboxilato
não é esperada em solução aquosa e caso ocorresse os números de onda do ν(C=O)
seriam menores no espectro do complexo e não maiores como se observa.
As bandas assimétrica e simétrica do ν(NH) do grupo -NH2 estão presentes e
também indicam a coordenação por tal grupo.
O grupo fenol da tirosina não participa da coordenação nesta espécie, o que é
confirmado pela inexistência de uma banda forte entre 3200 a 3250 cm-1, que é
característica de tal grupo quando ligado e em solução.
A estrutura proposta por modelagem molecular do complexo indicou que o Al(III)
apresenta estrutura octaédrica distorcida, figura 1.
A análise completa do espectro vibracional mostra que há boa concordância entre
o espectro Raman calculado e o espectro Raman experimental. As atribuições
vibracionais indicam um alto grau de acoplamento em todos os modos metal-
ligante.
Figura 1
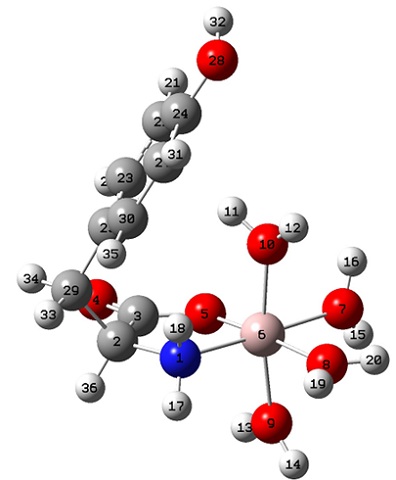
Complexo [Al(Tir)(H2O)4]2+
Tabela 1
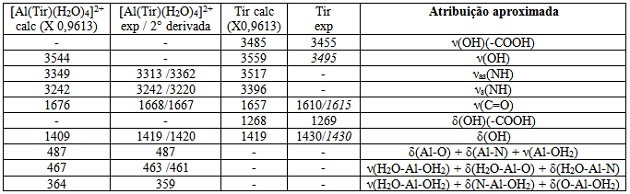
Principais bandas Raman do complexo e do ligante.
CONCLUSÕES: Em relação ao complexo binário [Al(Tir)(H2O)4]2+, as análises por espectroscopia
Raman confirmaram que o ligante comporta-se como bidentado coordenando-se pelo
átomo de oxigênio do grupo carboxilato e de nitrogênio do grupo amina.
Os valores dos cálculos ab initio para os números de onda Raman estão em
concordância com os valores experimentais do espectro.
No que tange à geometria molecular, os dados estruturais obtidos pelo DFT:
B3LYP/6-311G confirmaram a suposição de que a estrutura do complexo é octaédrica
distorcida.
AGRADECIMENTOS: O trabalho foi apoiado pelo CNPq, pela PUC-Rio e pela UFRJ.
REFERÊNCIAS BIBLIOGRÁFICA: BOHRER, D.; DO NASCIMENTO, P.C.; BINOTTO, R., CARLESSO, R. 2001. Influence of the glass packing on the contamination of pharmaceutical products by aluminium. Part II: Amino acids for parenteral nutrition. Journal of Trace Elements in Medicine and Biology, 15: 103–108.
FERREIRA, P. C.; PIAI, K. A.; TAKAYANAGUI, A. M.; SEGURA-MUÑOZ, S. I. 2008. Aluminum as a risk factor for Alzheimer's disease. Revista Latino-Americana de Enfermagem, 16: 151-157.
FRISCH, M.J.; TRUCKS, G.W.; SCHLEGEL, H.B.; SCUSERIA, G.E.; ROBB, M.A.; CHEESEMAN, J.R.; MONTGOMERY, J.A.; VREVEN, JR., T.; KUDIN, K.N.; BURANT, J.C.; MILLAM, J.M.; IYENGAR, S.S.; TOMASI, J.; BARONE, V.; MENNUCCI, B.; COSSI, M.; SCALMANI, G.; REGA, N.; PETERSSON, G.A.; NAKATSUJI, H.; HADA, M.; EHARA, M.; TOYOTA, K.; FUKUDA, R.; HASEGAWA, J.; ISHIDA, M.; NAKAJIMA, T.; HONDA, Y.; KITAO, O.; NAKAI, H.; KLENE, M.; LI, X.; KNOX, J.E.; HRATCHIAN, H.P.; CROSS, J.B.; ADAMO, C. ; JARAMILLO, J.; GOMPERTS, R.; STRATMANN, R. E.; YAZYEV, O.; AUSTIN, A. J.; CAMMI, R.; POMELLI, C.; OCHTERSKI, J. W.; AYALA, P.Y.; MOROKUMA, K.; VOTH, G. A.; SALVADOR, P.; DANNENBERG, J.J.; ZAKRZEWSKI, V.G.; DAPPRICH, S.; DANIELS, A.D.; STRAIN, M.C. ; FARKAS, O.; MALICK, D. K.; RABUCK, A. D.; RAGHAVACHARI, K.; FORESMAN, J. B.; ORTIZ, J. V.; CUI, Q.; BABOUL, A. G.; CLIFFORD, S.; CIOSLOWSKI, J.; STEFANOV, B. B.; LIU, G.; LIASHENKO, A.; PISKORZ, P.; KOMAROMI, I.; MARTIN, R.L.; FOX, D.J.; KEITH, T.; AL-LAHAM, M.A.; PENG, C. Y.; NANAYAKKARA, A.; CHALLACOMBE, M.; GILL, P. M. W.; JOHNSON, B.; CHEN, W.; WONG, M. W.; GONZALEZ, C.; POPLE, J. A. 2003. Gaussian, Inc., Pittsburgh.
HUANG, X.; ATWOOD, C. S.; HARTSHORN, M. A.; MULTHAUP, G.; GOLDSTEIN, L. E.; SCARPA, R. C.; CUAJUNGCO, M. P.; GRAY, D. N.; LIM, J.; MOIR, R. D.; TANZI, R. E.; BUSH, A. I. 1999. The A beta peptide of Alzheimer's disease directly produces hydrogen peroxide through metal ion reduction. Biochemistry, 38: 7609-7616.
SILVA, A. M.; FELCMAN, J. 2003. Estudo de complexos de cobre(II) e alumínio(III) com a fosfocreatina, o adenosina 5' trifosfato e alguns aminoácidos. Tese (Química), PUC-RJ.
