ÁREA: Química Inorgânica
TÍTULO: Estudo de Estabilidade Térmica e Liberação Controlada de Ibuprofeno Através do Uso de Xerogel de Sílica pH dependente
AUTORES: Vasconcelos, A.B.P. (UFRPE) ; Freire Belian, M. (UFRPE) ; Eduardo da Silva, W. (UFRPE)
RESUMO: Neste trabalho foi realizada a síntese e estudo da liberação controlada de ibuprofeno utilizando xerogel de sílica pH dependente. A síntese resultou em um sólido branco caracterizado termicamente e espectroscopicamente(UV-Vis). As curvas quanto a liberação controlada em pHs diferentes e as concentrações de ibuprofeno foram obtidas por espectroscopia(UV-Vis). A análise térmica sugere uma melhora das propriedades térmicas do ibuprofeno adsorvido no xerogel, pois isolado o ibuprofeno se decompõe a uma temperatura de 210 ºC, e após a adsorção o mesmo se decompõe a uma temperatura de 480 ºC. A análise quanto a capacidade de liberação controlada mostrou que o ibuprofeno é liberado em pH 7 após 10 minutos, sugerindo que o material proposto possui as características para ser aplicado clinicamente.
PALAVRAS CHAVES: Xerogel de sílica; análise térmica; ibuprofeno
INTRODUÇÃO: O Ibuprofeno, 2-[3-(2-metilpropil)fenil]ácido propanóico, é uma droga anti inflamatória amplamente comercializada, utilizada no tratamento de febre, enxaqueca, dores musculares, artrite e dores de dente [1]. Seu ponto de ebulição é 75 ~ 77ºC, e é caracterizado por ser um composto cristalino e incolor [2]. Uma das formas de aumentar a estabilidade térmica de compostos, é a utilização de matrizes como carreadores de fármacos. Neste trabalho foi utilizado um xerogel de sílica pH dependente, a fim de aumentar a estabilidade térmica e liberar gradativamente o ibuprofeno, em meio fisiológico. Compostos de sílica são amplamente utilizados por ser termicamente, mecanicamente e quimicamente estável, mantendo sua estrutura até mesmo quando submetida a altas condições de temperatura e pressão, além de apresentar grande resistência ao meio reacional [4]. Tais compostos podem ser obtidos através do processo sol-gel, onde dependendo das variáveis reacionais podem resultar na formação de um xerogel altamente poroso e com capacidade de aumento/diminuição do tamanho de poro frente às mudanças de pH [5].
MATERIAL E MÉTODOS: A síntese do xerogel foi feita utilizando o tetraetilortosilicato (TEOS) em meio etanólico e aquoso, e como catalisador foi usado o ácido acético. A síntese foi feita à temperatura ambiente e sob agitação durante 24h. Durante a síntese do xerogel foi adicionado o Ibuprofeno, garantindo o encapsulamento do mesmo. Após as 24h com a formação do xerogel, o mesmo foi secado em um evaporador rotativo até completa secura. A determinação de sua estabilidade térmica foi feita no equipamento TGA, onde foram utilizadas ~6 mg do xerogel, do xerogel contendo o ibuprofeno, e do ibuprofeno. A obtenção das curvas de liberação controlada foi feita através do uso da espectroscopia de absorção eletrônica, e a concentração de ibuprofeno liberado foi obtida a partir de uma curva de calibração de padrões do mesmo. Foram pesadas 10mg do xerogel com ibuprofeno e colocados em seguida em soluções tampões de pH 5, 6 e 7. Em cada solução tampão, foram tiradas alíquotas nos tempos de 1, 2, 5 e 10 min acumulativos.
RESULTADOS E DISCUSSÃO: O sólido obtido se apresentou na forma de um pó opaco branco, cujas características higroscópicas foram observadas e segundo os dados de análise termogravimétrica. Através da curva de TG é possível observar cerca de 50% em massa de água adsorvida, valores típicos de xerogéis de sílica obtidos através do processo sol-gel catalisado por água e ácido. Na Figura 1 são apresentadas as curvas de TG do Ibuprofeno e do Xerogel contendo o Ibuprofeno. Após análise das curvas obtidas é possível perceber que o xerogel adsorve eficientemente o ibuprofeno, além de interagir suficientemente para evitar sua termodegradação. Na curva apresentada em (B) é possível ainda perceber um primeiro evento térmico referente a perda de água adsorvida.
Na Figura 2 (A) é apresentada uma distribuição de pontos referente ao estudo de pH, mostrando a capacidade de liberação do ibuprofeno através da matriz de sílica.
Através de uma análise acerca da liberação de ibuprofeno em diferentes pHs, é possível observar que no pH 7 ocorre uma maior liberação do mesmo. Na Figura 2 (B) é apresentado o estudo da liberação controlada de ibuprofeno em diferentes tempos e pH 7. A distribuição de pontos mostrada na Figura 3 apresenta que apenas no tempo 10 minutos a liberação de ibuprofeno atinge um patamar de máxima liberação. Vale a pena salientar que para este estudo a amostra de xerogel+ibuprofeno ficou imerso em meio tamponado (fosfato).
Figura 1
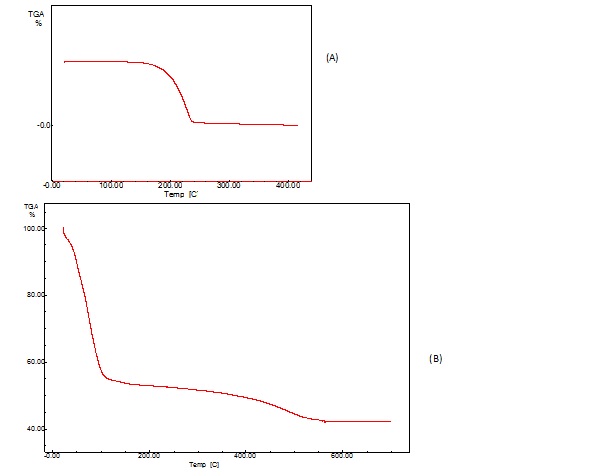
Curvas de TG das amostras de Ibuprofeno (A) e Xerogel de sílica + Ibuprofeno (B).
Figura 2
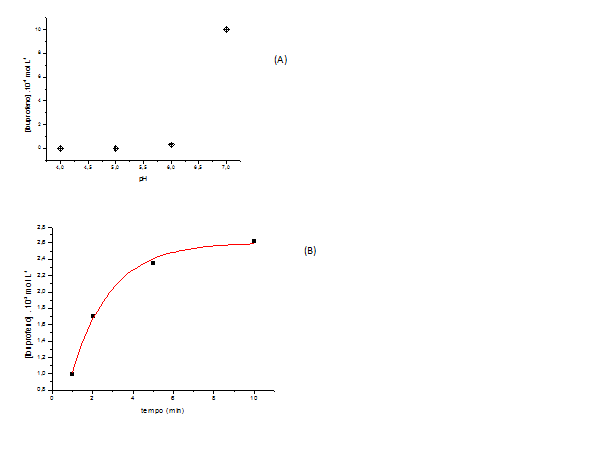
(A)Estudo da Liberação controlada de Ibuprofeno (concentração) em pHs diferentes; (B)Liberação de ibuprofeno em pH 7 em tempos diferentes.
CONCLUSÕES: Através do estudo da capacidade de adsorção, de estabilidade térmica e de liberação controlada de ibuprofeno em xerogel de sílica; é possível concluir que a matriz é promissora para seu uso clínico, uma vez que a adsorção de analgésicos como o ibuprofeno é feita em pH acima de 7 pelo intestino.
AGRADECIMENTOS: Agradeço ao Programa de Pós-Graduação em Química da UFRPE, ao Laboratório de Análise Química, Inorgânica e Sensores, a CAPES e aos meus orientadores.
REFERÊNCIAS BIBLIOGRÁFICA: [1] J. Madhavan, F. Grieser, M. Ashokkumar, Combined advanced oxidation processes for the synergistic degradation of ibuprofen in aqueous environments, J. Hazard. Mater. 178 (1–3) (2010) 202–208.
[2] S. Budavari (Editor), The Merck Index, llth Ed., Rahway, N.J., 1989, p. 4811.
[3]. Iler, R.K., The chemistry of silica, John Wiley & Sons, New York, 1979.
[4] PRADO, A. G. S.; FARIA, E. A.; PADILHA, P. M., Aplicação e modificação química da sílica gel obtida de areia, Quimica Nova, 28: 544, 2005.
[5] TAKAI, C.; FUJI, M.; TAKAHASHI, M., A novel surface designed technique to disperse silica nano particle into polymer, Colloids and surface A: Physicochemical and Engineering Aspects, 292: 79, 2007.
[6] Pavan, F. A.; Gobbi, S. A.; Costa, T. M. H.; Benvenutti, E. V.; J. Thermal. Anal. Calorim. 2002, 68, 199.
