ÁREA: Físico-Química
TÍTULO: DETERMINAÇÃO DE PARÂMETRO DE SOLUBILIDADE USANDO MICROCALORIMETRIA E ESPECTROSCOPIA NO ULTRAVIOLETA
AUTORES: Carvalho, S. (IMA/UFRJ) ; Spinelli, L. (IMA/UFRJ) ; Lucas, E. (IMA/LMCP)
RESUMO: O parâmetro de solubilidade é um parâmetro de coesão que descreve a interação em
materiais condensados e tem sido amplamente utilizado em vários campos de
pesquisa. Este trabalho avaliou a solubilidade de moléculas de baixa e de alta
massa molar. Primeiramente foram avaliadas amostras de parâmetros de
solubilidade tabelados, com o objetivo de validar procedimentos utilizando as
técnicas de microcalorimetria (µDSC) e espectroscopia no ultravioleta (UV) para
a determinação de δ. Os resultados obtidos por UV foram semelhantes aos da
literatura e àqueles obtidos pelo cálculo de entalpia de vaporização. Os valores
calculados para as amostras de polímeros foram coerentes com a polaridade de sua
estrutura. Os resultados preliminares usando µDSC mostram-se promissores para a
determinação de δ.
PALAVRAS CHAVES: Parâmetro de solubilidade; Microcalorimetria; Ultravioleta
INTRODUÇÃO: Hildebrand e Scott (1962) afirma que o parâmetro de solubilidade de um líquido é
igual à raiz quadrada da densidade da energia coesiva, na qual a energia do
líquido é a energia requerida para separar as moléculas presentes em 1cm³ e,
então, vaporizá-las; segundo a equação descrita por Hildebrand (1962). A
entalpia de vaporização pode ser determinada experimentalmente por calorimetria
diferencial de varredura, sendo restrita a moléculas de baixa massa molar.
A literatura apresenta também outro modelo conhecido de δ, o de Hansen, que é
baseado na contribuição das forças intermoleculares coesivas de uma substância,
ou seja, o sistema é constituído pelas seguintes interações: forças de dispersão
do tipo van der Waals (δD), forças das ligações de hidrogênio (δH) e forças das
interações dipolo-dipolo (δP), segundo a equação descrita por HANSEN(2007).
O parâmetro de solubilidade é extremamente importante para predizer a capacidade
de solubilização de sistemas, sendo particularmente útil para utilização de
produtos em formulações em diversas áreas, como, por exemplo, na indústria de
petróleo, onde são utilizados diversos aditivos para aplicações específicas, com
o objetivo de facilitar a produção. Deste modo, é de suma importância conhecer o
comportamento de fases dessas moléculas nos sistemas solventes usados nas
formulações (KELLAND, 2010). Por esse motivo este trabalho tem como objetivo
determinar o δ de produtos químicos (poliméricos ou não), com potencial de
aplicação na indústria do petróleo, utilizando duas técnicas distintas: a de
µDSC e a de UV, a fim de validá-las como técnicas eficientes na obtenção de
parâmetro de solubilidade semelhantes às técnicas comumente utilizadas para este
fim.
MATERIAL E MÉTODOS: As moléculas de baixa massa molar estudadas são todas comerciais e foram usadas
como recebidas. São elas: pireno, naftaleno, perileno e fenantreno. Amostras de
poliestireno com diferentes graus de sulfonação também foram utilizadas: essas
amostras foram sintetizadas no Laboratório de Macromoléculas e Coloides na
Indústria de Petróleo (LMCP). Os solventes utilizados para avaliar δ foram
dioxano, etanol e hexano, todos comerciais usados como recebidos.
Todos os materiais foram analisados em espectrofotômetro de ultravioleta visível
Cary 50, Varian e microcalorímetro (µDSCIII), Setaram, equipado com duas células
de aço inox, com exceção das moléculas de baixas massas molares que também foram
testadas em calorímetro diferencial de varredura. DSC Q200, TA Instruments.
Nas análises de espectrofotômetro de ultravioleta, primeiramente foram feitas
varreduras de 200 a 800nm a fim de definir comprimentos de ondas específicos
para a realização das leituras simples de cada molécula analisada, com o
objetivo de avaliar absorbâncias para cada proporção de pares de solventes. Além
dos solventes puros, foram utilizadas também algumas misturas, tais como:
dioxano/hexano, dioxano/etanol, e as concentrações foram escolhidas de modo a
obedecer a lei de L’Ambert- Beer em relação a sensibilidade do equipamento,
sendo essa 0,5% p/v.
A metodologia usada no microcalorímetro foi à mesma utilizada por Garreto
(2011), diferenciando somente a massa do produto e volume de solvente, que foram
1mg e 100µL respectivamente. Foram realizadas no mínimo 3 medidas para cada
sistema.
A análise de DSC, foi realizada numa rampa de aquecimento de 10ºC/min de 25ºC a
200ºC, sob aeração de nitrogênio, com o objetivo de determinar a entalpia de
vaporização das moléculas de baixa massa molar.
RESULTADOS E DISCUSSÃO: UV- Figura 1(A) mostra um pico de absorção no valor de δ igual a 20,5 MPa1/2,
referente ao δ do dioxano puro, sendo este próximo ao δ do fenantreno
(20 MPa1/2). Já na figura 1(B) referente ao naftaleno, que de acordo
com Barton (1983) possui δ igual a 20,2 MPa1/2, pode-se observar um pico
na mistura 10:90 hexano/dioxano, que possui o δ igual a 19,94 MPa1/2 .
Portanto, sugere-se que a técnica utilizada foi satisfatória, por ter fornecido
valores de δ dos produtos semelhantes aos da literatura e àqueles determinados
pela técnica de calorimetria(ΔH). Neste caso foi utilizada a premissa de que
“semelhante dissolve semelhante” (BARTON, 1983; HANSEN, 2007).
µDSC- Os resultados preliminares, realizados com pireno, fenantreno, naftaleno e
perileno nos solventes dioxano e etanol, são mostrados na Figura 2. Estes
resultados mostram que esta técnica é muito promissora para a determinação do δ
uma vez que os resultados de entalpia de solubilização foram coerentes, isto é,
para um mesmo soluto, a entalpia de solubilização se mostrou mais elevada quando
um solvente de δ mais semelhante ao do soluto foi adicionado, devido às
interações intermoleculares envolvidas no sistema.
Os ensaios de espectroscopia de ultravioleta foram também realizados para as
amostras de poliestireno com diferentes graus de sulfonação. Os resultados de δ
obtidos para as amostras de polímeros foram coerentes com os graus de
sulfonação: graus de sulfonação mais elevados tornam a molécula mais polar e,
portanto, seu δ também é maior. Estes resultados serão ainda comparados com
aqueles obtidos por medidas de viscosidade intrínseca da dispersão polimérica em
função do δ do solvente utilizado – técnica convencional de determinação de δ de
polímeros, a qual é extramente trabalhosa.
Figura 1
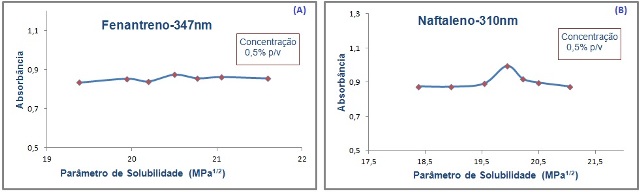
Parâmetro de solubilidade versus (A)-absorbância
do Fenantreno no comprimento de onda 347nm.(B)-
absorbância do Naftaleno no comprimento de onda
310nm.
Figura 2
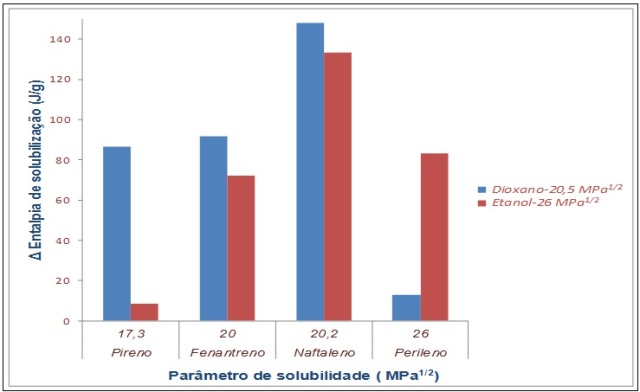
Parâmetro de solubilidade em função da entalpia de
solubilização para hidrocarbonetos poliaromáticos.
CONCLUSÕES: Os procedimentos de determinação de intensidade de absorção de luz ultravioleta e
de entalpia de solubilização (usando microcalorímetro) em função do parâmetro de
solubilidade de solventes mostraram-se adequados para a determinação de parâmetro
de solubilidade de solutos.
No caso de moléculas de elevada massa molar, quando a entalpia de vaporização não
pode ser calculada, os procedimentos usados neste trabalho, os quais são
relativamente simples, são particularmente úteis para a determinação de
solubilidade.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: - BARTON; A.F.M., Handbook of Solubility Parameters and Other Cohesion
Parameters, CRC Press, Boca Raton, FL, 1983.
- GARRETO M. S. E, Tese de Doutorado, Universidade Federal do Rio de Janeiro, 2011.
- HANSEN, C. M. Solubility Parameters, A User’s Handbook, 2 ed., CRC Press:
Boca Raton, FL, 2007.
- HILDEBRAND, J.; SCOTT, R., “Regular Solutions,” Prentice-Hall, Englewood Cliffs, S. J.,1962.
- KELLAND, M. A. Production chemicals for the oil and gas industry. New York: Crc Press, 2010.
