ÁREA: Físico-Química
TÍTULO: ESTUDO DAS PARTÍCULAS DE GLICEROL EM SOLUÇÕES DE DIFERENTES CONCENTRAÇÕES
AUTORES: dos Santos Alves, D. (UNIVERSIDADE ESTADUAL DE GOIÁS (UEG))
RESUMO: O objetivo deste trabalho é avaliar a distribuição das partículas de glicerol em soluções de diferentes concentrações (entre 0,0678 mol/L e 0,678 mol/L). De acordo com algumas aproximações necessárias como a consideração do formato das micelas e quantidade das mesmas na fase dispersa, são possíveis análises do comportamento não somente da massa específica das soluções (entre 0,9958 g/mL e 1,1464 g/mL) viscosidade relativa (entre 1,1769 e 6,8033), mas também do raio das micelas (entre 74,5 nm e 110,8 nm) em função da concentração. O estudo a cerca de suspensões em geral, são extremamente importantes na aprendizagem da química, em especial o comportamento das emulsões, que estão presente no dia-a-dia em diversos produtos como o leite, maionese e outros.
PALAVRAS CHAVES: Glicerol; Viscosidade Relativa; Raio das micelas
INTRODUÇÃO: O estudo de partículas em solução é extremamente importante em físico-química experimental, visto que é possível calcular propriedades físicas de suspensões como o raio das micelas formadas [1]. As emulsões e as suspensões constituem setores importantes no estudo de partículas sólidas e líquidas [2].
Uma emulsão é um sistema heterogêneo, consistindo de ao menos um líquido imiscível (fase interna descontínua - glicerol) disperso em outro (fase externa contínua – água destilada) em forma de pequenas gotas, com o diâmetro que, em geral, excede 0,1µm [3].
A relação entre a viscosidade é dada equação (1), onde a mesma depende do tempo de escoamento e da densidade da solução e das propriedades do solvente (no caso, a água).
ɳ/ɳ0 =td /(t0d0) (1)
Sendo que ɳ e ɳ0 se referem a viscosidade do soluto e do solvente, respectivamente, t e t0 referem-se ao tempo de fluxo de um dado volume de solvente e solução, d e d0 as massas específicas do solvente puro e da solução [4].
Considerando-se uma solução de partículas esféricas cuja viscosidade é igual a ƞ e a viscosidade do solvente igual a ƞ0, se a concentração das soluções dependem diretamente do raio, pode-se escrever a seguinte expressão:
ɳ/ɳ0 =1+6,3*10^21*r^3*c (2)
Sendo r é o raio da partícula e c a concentração de partículas em mols por litro [5], [6].
Portanto o objetivo do trabalho é determinar e verificar a relação entre a viscosidade relativa e o raio das micelas de glicerol em soluções aquosas.
MATERIAL E MÉTODOS: Cálculo da densidade de cada solução:
Com o auxilio de uma proveta de 5 mL, adiciona-se completamente o volume da mesma e pesa-se (lembrando de tarar a proveta), após 3 medições de peso, tem-se a média dos resultados e logo um peso para cada solução. A água também é usada para determinar o volume da proveta, sabendo que a temperatura foi aferida e estava a 22,5ºC tem-se que a essa temperatura a densidade da mesma é de 0,9836 g/mL [7], achou-se um volume de 4,9227 mL para a proveta.
Determinação da viscosidade das soluções: Adiciona-se 15 mL de cada solução no viscosímetro de Ostwald (com auxílio de uma proveta), depois de adicionada a solução com uma pêra e um cronômetro determinou-se o tempo que cada solução levou para percorrer o tempo marcado por Ostwald (de um menisco a outro), após cada solução lava-se o viscosímetro a fim de eliminar qualquer tipo de interferente, primeiramente com água e depois a homogeneização do aparelho com a próxima solução (sugere-se começar a determinar as viscosidades a partir das menos concentradas para as mais concentradas, isso diminui a interferência de cada solução sobre a próxima, caso não seja adequadamente lavada) [8].
RESULTADOS E DISCUSSÃO: As soluções preparadas de glicerol e são mostradas na Tabela 1 assim como a densidade e a viscosidade de cada solução.
Tabela 1: Resultados encontrados
Sabendo que a viscosidade da água é de: 1,006 à 20ºC, pode-se calcular a viscosidade para cada solução com a equação 1.
De acordo com a Tabela 1 obtém-se a Figura 1 que mostra em (a) o comportamento do gráfico: viscosidade relativa x concentração e em (b) o comportamento do gráfico: raio das partículas x concentração e de acordo com o programa Microsoft Office Excel 2010 obtêm-se as equações gerais das retas.
Para (a), tem-se:
Viscosidade = 9,2608*Concentração-0,0765
Cujo coeficiente de linearidade é igual a r2 = 0,9106.
Para (b), tem-se:
Raio= 61,266*Concentração+66,403
Cujo coeficiente de linearidade é igual a r2 = 0,9433.
Figura 1: Gráfico experimental em (a) da viscosidade relativa x concentração e em (b) do raio das partículas x concentração.
De acordo com os dados experimentais e empíricos os raios atômicos mudam de valor com as concentrações, que pode ser explicado devido às interações moleculares, nota-se que assim como a viscosidade relativa e o raio das partículas aumentam com a concentração, logo a análise da viscosidade relativa com o raio das partículas, que é comprovado de acordo com a equação 2.
Analisa-se também que com o aumento do tempo propiciando uma maior viscosidade relativa, observa-se qualitativamente que a tensão superficial das soluções também aumenta com a concentração.
Um erro pode ser considerável no experimento: a viscosidade da água encontrada na literatura (20ºC) e a viscosidade real da água no experimento (22,5ºC).
Tabela 1: Resultados Encontrados
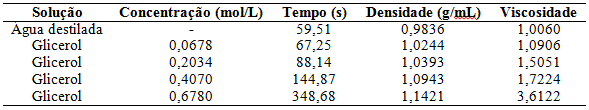
Figura 1: Gráfico experimental
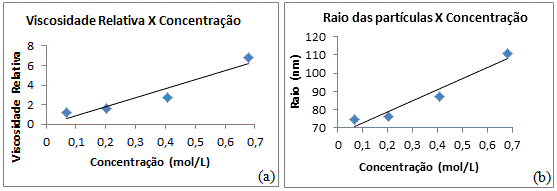
Em (a) da viscosidade relativa x concentração e em (b) do raio das partículas x concentração.
CONCLUSÕES: Observa-se que além dos fenômenos superficiais devidos a agentes externos há também outros efeitos que influenciam nas características das partículas como viscosidade relativa e raio das mesmas, isso porque as interações entre as moléculas aumentam com a quantidade de partículas presentes na solução, ou seja, concentração.
Verifica-se que a velocidade de queda no viscosímetro de Ostwald e através de observações a tensão superficial depende assim como os demais fatores da concentração das soluções.
AGRADECIMENTOS: Primeiramente a Deus pela oportunidade.
A minha mãe Romilda pela força.
A Jean C., Daniel, Érica, Lorrane, Diego e Jaqueline.
REFERÊNCIAS BIBLIOGRÁFICA: [1] WILSON, NEWCOMBE, DENARO and RICKETT, Experiments in Physical Chemistry, Pergamon Press (1962).
[2] TAGER, A., Physical Chemistry of Polymers, MIR Moscou (1972).
[3] BARROS, F. F. C., QUADROS, C. P., JÚNIOR, M. R., PASTORE, G. M. Surfactina: Propriedades Químicas, Tecnológicas e Funcionais para Aplicações em Alimentos. Universidade Estadual de Campinas. Campinas – SP, 2007.
[4] GUGGENHEIM, E., Physical Chemical Calculations, North-Holland Publishing Co. (1955).
[5] BECHER, P., Emulsions Theoy and Pratic, ACS Monograph nº. 162.
[6] SHAW, D. Introdução a Química dos Colóides de Superfície, Editora Edgard Blücher e EDUSP (1975).
[7] PIERRE, T. D. S. Densidade. Creative Commons, 2008.
[8] LAUFFER, A., Motion in Viscous liquids, J. of Chem. Ed., Vol 58, nº. 3, p.250-256, March (1981).
