ÁREA: Química Analítica
TÍTULO: EFEITO DA FORÇA IÔNICA SOBRE A QUANTIFICAÇÃO DO VERDE DE BROMOCRESOL POR ESPECTROFOTOMETRIA UV-VIS
AUTORES: Lopes, A. (UTFPR) ; Martin, C.A. (UTFPR) ; David, D. (UTFPR) ; Boffo, E.V. (UTFPR) ; Finco, G.F. (UTFPR) ; Tonel, J.J. (UNIOESTE) ; Maestre, K.L. (UTFPR) ; Almeida, P.B. (UTFPR)
RESUMO: Este experimento objetivou a quantificação do indicador verde de bromocresol por
espectrometria UV-VIS, tomando como referência o comprimento de onda de 616 nm e
443 nm, valores máximos e mínimos de absorção em solução pura do indicador, e
medindo-se a absorvância nesta região em soluções com distintos valores de força
iônica. O valor de força iônica de 0,001 demonstrou maior valor de absorvância,
por não haver interação do eletrólito e da molécula absorvente.
PALAVRAS CHAVES: Verde de Bromocresol; Absorvância; Força Iônica
INTRODUÇÃO: A espectroscopia de radiação ultravioleta-visível (UV-VIS) é uma ferramenta
utilizada em análises quantitativas que dependem da medição de propriedades
elétricas ou na medida da intensidade de radiação emitida e absorvida, sendo as
radiações ultravioletas utilizadas para a detecção de grupos cromóforos em
soluções diluídas (SKOOG, 2006).
O indicador verde de bromocresol, é um ácido orgânico fraco, com denominação
química de tetrabromometacresolsulfonoftaleína e fórmula molecular C21H14Br4O5S,
resultando em uma massa molecular de 698,01386 g.mol-1, sua constante
de ionização (pKa) corresponde a 4,66, em força iônica 0,1, constitui-se de dois
átomos de hidrogênio doadores e cinco átomos de hidrogênio aceptores. A mudança
de coloração deste corante ocorre devido a concentração de íon hidrogênio na
solução, do amarelo para solução predominante ácida para o azul em solução
predominante alcalina, variando entre os pH 3,8 e 5,4, este intervalo de pH é
influenciado pela temperatura, pela força iônica e pela presença de solventes
orgânicos e partículas coloidais. A força iônica é uma medida da concentração
total de íons em solução, a adição de um sal inerte (Cloreto de Sódio, por
exemplo) aumenta a solubilidade de um composto iônico (ATKINS, 2006, P.519;
SKOOG, 2006, P. 351; VOGEL, 1992, P.219).
MATERIAL E MÉTODOS: Além do indicador já citado, utilizaram-se as soluções dos seguintes compostos:
Etanol 0,1 mol.L-1, Ácido Clorídrico 0,01 mol.L-1,
Hidróxido de Sódio 0,01 mol.L-1, Cloreto de Sódio 0,1
mol.L-1 e Água Destilada.
A solução estoque do corante verde de bromocresol foi preparada em um balão
volumétrico de 500,0 mL, pela dissolução de 0,1 g do indicador, pesado em
balança analítica SHIMADZU modelo AY220, em 5,0 mL de etanol e, a seguir,
completando-se o volume com água (solução final com 1% deste álcool). Retirou-se
uma alíquota de 75,00 mL que em seguida foi transferida para um novo balão de
500,0 mL, completando-o com água destilada.
Visto que o verde de bromocresol é um indicador ácido, determinaram-se os
comprimentos de onda com máximo e mínimo de absorvância deste corante puro,
respectivamente 616 e 443 nm, sendo estes valores considerados referência para
as demais soluções. Os espectros desta e das demais soluções aquosas foram
obtidos em um espectrofotômetro de varredura PG INSTRUMENTS, modelo T80+,
acoplado a um microcomputador e cubetas de vidro com caminho óptico de 1,0 cm.
Para determinar os efeitos da força iônica sobre a quantificação do indicador,
manteve-se o pH das soluções constante na faixa de 9,11 e variou-se a
concentração da solução de NaCl, utilizando-se o mesmo volume da solução do
indicador (40,00 mL) e também da solução de NaCl (60,00 mL), visando que o
volume médio de Hidróxido de Sódio para alcançar o pH desejado foi de
aproximadamente 0,83 mL.
RESULTADOS E DISCUSSÃO: As variações da força iônica, juntamente com o pH ajustado e seus respectivos
valores de absorvância nos comprimentos de onda referenciais são denotados na
Figura 1:
O espectro desta análise demonstra uma sobreposição das curvas de absorvância
das cinco soluções. Construiu-se o gráfico de força iônica versus absorvância no
comprimento de onda máximo (Figura 2) a fim de se averiguar influências sobre a
absortividade molar das soluções.
As conclusões obtidas pela determinação gráfica, validou-se apenas para o
comprimento de onda máximo, pois para o comprimento de onda mínimo obteve-se,
após regressão da curva de absorção, um valor muito baixo para R².
Analisando-se a Figura 2, segundo HOLLER et al. (2009), infere-se que à medida
que se aumenta a concentração do eletrólito, ou seja, aumento da força iônica da
solução, há uma maior interação dos íons com a espécie absorvente, fato, este,
que justifica a diminuição da absorvância com o aumento da concentração da
solução de NaCl, pois o indicador é solvatado por esses íons, o que acarretará
na diminuição da concentração do verde de bromocresol. Observando-se ainda o
gráfico, percebe-se que, ao realizar a regressão logarítmica da curva, o modelo
consegue explicar 96,1 % (R² = 0,961) da variabilidade dos dados experimentais.
Figura 1
Variação da força iônica nas soluções e seus
valores de pH
Figura 2
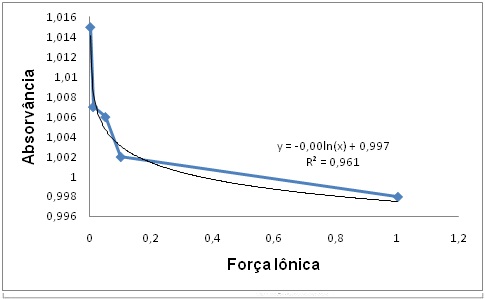
Perfil de intensidade de absorção do verde de
bromocresol em função da força iônica, em 616 nm.
CONCLUSÕES: A espectrometria UV-VIS mostrou-se um método instrumental de alta confiabilidade
e praticidade para a determinação dos efeitos da força iônica sobre a
quantificação do indicador verde de bromocresol. A partir do ponto de absorção
máxima da solução em pH distintos, neste mesmo comprimento de onda, observou-se
que a força iônica de 0,001 obteve a maior absorvância (1,015), pois havia pouca
interação entre o eletrólito e a espécie absorvente, visto que a concentração da
solução de NaCl, neste caso, era a menor.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ATKINS, Peter; JONES, Loretta. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 3ₐ ed. – Porto Alegre: Bookman, 2006.
HOLLER, F. James; SKOOG, Douglas A.; CROUCH, Stanley R. Princípios de Análise Instrumental. 6ª ed. Porto Alegre: Bookman, 2009.
SKOOG, Douglas. A., et al. Fundamentos de Química Analítica. 8ª ed. São Paulo: Thomson, 2006.
VOGEL, Arthur I. Análise Química Quantitativa. 5ₐ edição - Rio de Janeiro: LTC, 1992.
