ÁREA: Química Analítica
TÍTULO: Síntese, propriedades térmicas e estudos espectroscópicos dos mandelatos de Mn(II), Fe(II) e Co(II) no estado sólido.
AUTORES: Gomes, D.J.C. (UNESP) ; Gigante, A.C. (UNESP) ; Caires, F.J. (UNESP) ; Ionashiro, M. (UNESP) ; Lima, L.S. (UNESP)
RESUMO: Mandelatos de Mn(II), Fe(II) e Co(II) foram sintetizados, caracterizados e
investigados utilizando-se termogravimetria e calorimetria exploratória
diferencial simultânea (TG-DSC), espectroscopia na região do infravermelho (FTIR)
e complexometria. Os resultados permitiram estabelecer a estequiometria,
estabilidade e comportamento térmicos desses compostos.
PALAVRAS CHAVES: metais de transição ; mandelatos; comportamento térmico
INTRODUÇÃO: O ácido mandélico (ácido α-hidroxifenil acético) C6H5CH(OH)CO2H, tem uma longa
história de seu uso na medicina como agente antibacteriano, particularmente no
tratamento de infecções urinárias [1]. Durante a revisão bibliográfica verificou-
se que os trabalhos envolvendo os mandelatos de metais de transição bivalentes
apresentam informações a respeito da estrutura [2], espectros de absorção na
região do infravermelho [3], propriedades magnéticas [4]. Poucos estudos
utilizando técnicas termoanalíticas foram encontrados na literatura.
MATERIAL E MÉTODOS: Os mandelatos (L) de Mn(II), Fe(II) e Co(II) foram obtidos misturando
100 ml de solução de mandelato de sódio 0,1 mol L-1 com 50 mL da solução dos
respectivos íons metálicos 0,1 mol L-1. A mistura resultante foi mantida, por
trinta minutos, sob agitação e aquecida até próximo à ebulição. Os precipitados
formados foram lavados com água destilada até eliminação dos íons cloreto (Mn e
Co) e sulfato (Fe), secos em estufa de circulação forçada a 50 °C durante 12 h e
guardados em dessecador contendo cloreto de cálcio anidro.
Os teores dos íons metálicos e dos ligantes foram obtidos a partir das curvas TG
e também por complexometria com EDTA.
Os espectros de absorção na região do infravermelho foram obtidos em
espectrômetro Nicolet iS10 FTIR, utilizando acessório ATR com janela de
germânio.
As curvas TG-DSC simultâneas foram obtidas utilizando os sistemas TG-DSC
1Stare da Mettler Toledo, atmosfera dinâmica de ar seco com vazão de 50 mL min-
1, massa de amostra em torno de 10 mg, razão de aquecimento de 10 °C min-1 em um
cadinho de α-alumina.
RESULTADOS E DISCUSSÃO: Os espectros de absorção na região do infravermelho mostram que os
estiramentos assimétricos νas(COO-), ν(OH) e ν(C-OH) estão deslocados para
menores energias em relação ao observado no ácido livre, como apresentado na
Tabela 1, isto sugere que a coordenação do ligante aos centros metálicos ocorre
através do grupo hidroxila e de um oxigênio do grupo carboxila, sugerindo o modo
de coordenação como bidentado- quelante. No MnL2 as perdas de massa ocorrem em
duas etapas entre 160-250 °C e 250-320 °C com perdas de 65,215% e 12,69%,
respectivamente, correspondendo aos picos exotérmicos em 250 °C e 310 °C na
curva DSC, que são atribuídos à oxidação da matéria orgânica. A perda de massa
até 320 °C está de acordo com a formação de Mn3O4 como resíduo final
(Calc=78,65%; TG=77,90%; EDTA = 78,12%). No FeL2 as perdas de massa ocorrem em
quatro etapas entre 80-195 °C,
195-230 °C, 230-330 °C e 330-345 °C, com perdas de 29,32%, 18,40%, 17,79% e
12,10%, respectivamente, correspondendo aos picos exotérmicos em 195 °C, 210 °C
e
340 °C na curva DSC, que são atribuídos à reação de oxidação do Fe(II) a Fe(III)
e também a oxidação do ligante. Indício de eventos térmicos em correspondência a
terceira perda de massa sugere que reações endotérmicas e exotérmicas devem
estar a ocorrendo simultaneamente. A perda de massa até 345 °C está de acordo
com a formação de Fe2O3 como resíduo final (Calc=77,70%; TG=77,61%; EDTA =
77,91%). No CoL2 as perdas de massa ocorrem em duas etapas entre 230-335 °C e
335-400 °C com perdas de 62,58% e 15,14%, respectivamente, correspondendo aos
picos exotérmicos em 330 °C e 355 °C na curva DSC, atribuídos à oxidação do
ligante. A perda de massa até 400 °C está de acordo com a formação de Co3O4 como
resíduo final (Calc = 77,78%; TG = 77,72 %; EDTA = 77,11%).
Figura 1
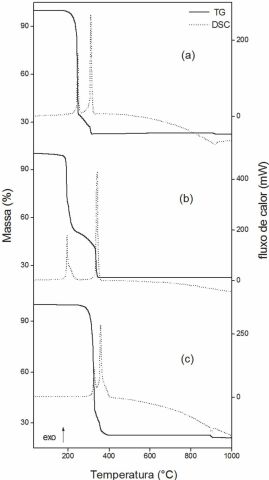
Curvas TG-DSC simultâneas dos compostos. (a) MnL2
(m=10,0600 mg),
(b) FeL2 (m= 10,0190 mg), (c) CoL2 (m = 10,0440
mg).
Figura 2
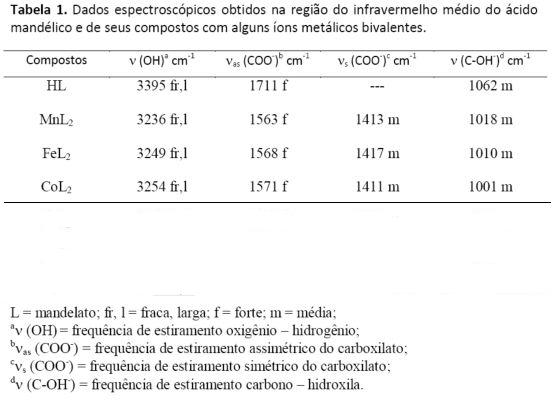
Dados espectroscópicos obtidos na região do
infravermelho médio do ácido mandélico e de seus
compostos com alguns íons metálicos bivalentes.
CONCLUSÕES: Os resultados da complexometria e das curvas TG permitiram estabelecer a
estequiometria desses compostos.
Os espectros de absorção na região do infravermelho permitiram sugerir
que os íons metálicos são coordenados pelos grupos hidroxila e carboxila.
As curvas TG-DSC simultâneas permitiram verificar que os compostos foram
obtidos no estado anidro e que a decomposição térmica ocorre em duas ou quatro
etapas com perda de massa em intervalos de temperatura característicos de cada
composto.
AGRADECIMENTOS: Os autores agradecem a FAPESP, CNPQ e CAPES pelo seu apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Putten, P.L. Antonie Van Leeuwenhoek 45(1975) 622-3.
[2] Fischinger, A.; Sarapu, A.; Companion, A. Can. J. Chem. 47 (1963) 2929-37.
[3] Khadikar, P.U. Chauhan, S. D. Kekre, M. G. Ameria, R. L. Sci Culture 37 (10) (1971) 491-2.
[4] Inorg. Chem. (2005) 662-9.
