ÁREA: Química Analítica
TÍTULO: QUANTIFICAÇÃO DE PERÓXIDO DE HIDROGÊNIO EM ANTISSÉPTICOS BUCAIS POR MÉTODOS VOLUMÉTRICOS
AUTORES: Santana, E.A. (UFTM) ; Paula, C.D. (UFTM) ; Costa, C.R. (UFTM)
RESUMO: O peróxido de hidrogênio é um oxidante químico utilizado como componente ativo em antissépticos bucais. A concentração de peróxido de hidrogênio pode ser determinada por diferentes métodos analíticos dentre os quais se encontram os métodos volumétricos de oxi-redução. Uma vez que os antissépticos bucais apresentam em suas composições outras substâncias além do peróxido de hidrogênio, essas substâncias podem interferir na análise levando a resultados errôneos, fenômeno conhecido como efeito de matriz. Neste trabalho são apresentados os resultados obtidos na quantificação de peróxido de hidrogênio nos antissépticos bucais Colgate® Plax® Whitening e Listerine® Whitening por três métodos volumétricos de oxi-redução: iodometria, permanganimetria e cerimetria.
PALAVRAS CHAVES: peróxido de hidrogênio; volumetria de oxi-redução; antissépticos bucais
INTRODUÇÃO: O peróxido de hidrogênio é um oxidante químico seguro, de baixo custo, altamente solúvel em água e que pode ser facilmente estocado (MEUNIER, 1992). Ele apresenta aplicações no branqueamento da polpa de papel e de fibras têxteis; na manufatura e produção de oxidantes químicos, como persulfato e percarbonato; no tratamento de superfícies metálicas; no tratamento de efluentes; na indústria de alimentos; na desinfecção de instrumentos odontológicos e cirúrgicos; e como componente de alvejantes, detergentes, cosméticos e produtos de higiene pessoal (ARKEMA, 2012). Dentro desta última aplicação, podemos destacar a utilização do peróxido de hidrogênio em antissépticos bucais. A FDA (Food and Drug Administration), que é o órgão governamental dos Estados Unidos que realiza o controle dos alimentos e dos medicamentos para humanos e animais, aprovou o uso de peróxido de hidrogênio como agente antisséptico oral em 1983 (SCCP, 2007). A concentração recomendada e considerada eficaz e segura para uso bucal é de 1,5 a 3,0% (SCCP, 2007). Concentrações de peróxido de hidrogênio superiores a 3% são capaz de provocar lesões nos tecidos moles devido ao seu efeito cáustico (CONSOLARO et al., 2011.). Devido ao risco que o peróxido de hidrogênio apresenta para os usuários de antissépticos bucais que o contenha, torna-se importante averiguar suas concentrações nestes produtos. Neste trabalho são apresentados os resultados obtidos na quantificação de peróxido de hidrogênio nos antissépticos bucais Colgate® Plax® Whitening e Listerine® Whitening por três métodos volumétricos: iodometria, permanganimetria e cerimetria. Os resultados foram comparados entre si e com a concentração do rótulo, quando informada.
MATERIAL E MÉTODOS: A quantificação de peróxido de hidrogênio nos antissépticos bucais Colgate® Plax® Whitening e Listerine® Whitening por iodometria foi realizada de acordo com procedimento descrito a seguir (CHRISTIAN, 1986): em um erlenmeyer foram adicionados 540 μL de antisséptico bucal, cerca de 100 mL de água, 5 mL de ácido acético glacial (Vetec), 2 g de iodeto de potássio (Proquimios) e 5 gotas de molibdato de amônio (Vetec) 3%. A titulação foi então realizada com solução padrão de tiossulfato de sódio (Isofar) 0,0945 mol/L usando solução de amido (Dinâmica) 1% como indicadora, até ser observado o desaparecimento da coloração azul. A quantificação de peróxido de hidrogênio nos dois antissépticos bucais por permanganimetria foi realizada de acordo com procedimento descrito a seguir (BACCAN, 1979): em um erlenmeyer foram adicionados 960 μL de antisséptico bucal, cerca de 100 mL de água e 5 mL de ácido sulfúrico concentrado (Fmaia). A solução foi então titulada com solução padrão de permanganato de potássio (Cinética) 0,0349 mol/L, sob agitação e leve aquecimento, até a coloração violeta do permanganato de potássio persistir por, pelo menos, 30 s. Na quantificação de peróxido de hidrogênio nos antissépticos bucais por cerimetria foram adicionados em um erlenmeyer 100 μL de antisséptico bucal, cerca de 100 mL de água, 5 mL de ácido sulfurico concentrado (Fmaia) e 300 μL de indicador ferroína (VOGEL, 1989). A solução foi então titulada com sulfato de cério IV (Vetec) 0,01641 mol/L. A titulação foi realizada até ser observada uma mudança de coloração de vermelho alaranjada para azul clara. Todos os procedimentos foram realizados em triplicata.
RESULTADOS E DISCUSSÃO: Nas Tabelas I e II são apresentados os resultados obtidos na determinação do peróxido de hidrogênio para os antissépticos bucais Colgate® Plax® Whitening e Listerine® Whitening, respectivamente. Os dados mostram que, a concentração de peróxido de hidrogênio no antisséptico bucal Colgate® Plax® Whitening é menor do que no Listerine® Whitening. A concentração de peróxido de hidrogênio informada no rótulo do antisséptico bucal Colgate® Plax® Whitening é de 1,5%. Os resultados obtidos por iodometria e cerimetria são inferiores a 1,5%, mas próximos deste valor, enquanto que o resultado obtido por permanganimetria é superior, mas também encontra-se situado no intervalo de concentração recomendado pela FDA. O antisséptico bucal Listerine® Whitening não informa a concentração de peróxido de hidrogênio em seu rótulo. Embora valores diferentes de concentração de peróxido de hidrogênio tenham sido obtidos por iodometria e cerimetria para os dois antissépticos bucais, eles apresentam melhor concordância entre si do que com os resultados obtidos por permanganimetria, sendo que neste caso, as concentrações obtidas foram superiores para os dois antissépticos bucais. Uma vez que os antissépticos bucais apresentam também outras substâncias como constituintes, estas substâncias podem interferir na análise levando a resultados subestimados ou superestimados. O íon permanganato possui um potencial de redução de 1,61 V em solução ácida, enquanto que para o íon cério IV, o potencial de redução depende fortemente da natureza e da concentração de ácido (OHLWEILER, 1981). Em soluções de ácido sulfúrico, o potencial de redução do cério IV pode variar de 1,42 a 1,44 V. A maior capacidade oxidante do permanganato pode fazê-lo capaz de oxidar outros constituintes dos antissépticos bucais.
Tabela I
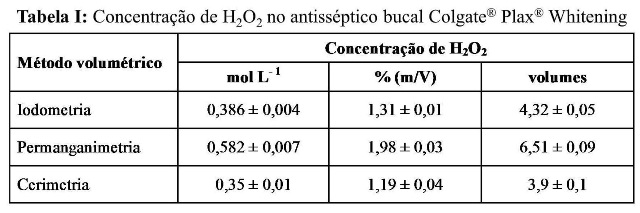
Concentração de peróxido hidrogênio no antisséptico bucal Colgate® Plax® Whitening
Tabela II
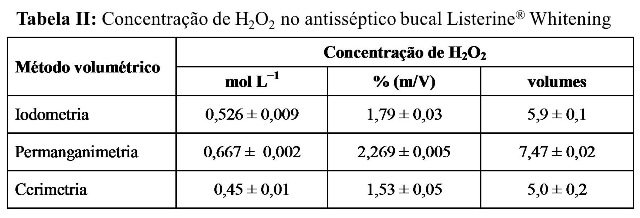
Concentração de peróxido de hidrogênio no antisséptico bucal Listerine® Whitening
CONCLUSÕES: Os resultados mostraram que a diferença entre a concentração de peróxido de hidrogênio determinada por iodometria e a determinada por cerimetria é menor do que a diferença entre a concentração de peróxido de hidrogênio determinada por cada um destes métodos e a determinada por permanganimentria. Os resultados mostraram também que a concentração de peróxido de hidrogênio no antisséptico bucal Listerine® Whitening é maior do que no Colgate® Plax® Whitening e que as concentrações obtidas por todos os métodos volumétricos empregados neste trabalho foram inferior a 3,0%, como recomendado pela FDA.
AGRADECIMENTOS: À Universidade Federal do Triângulo Mineiro (UFTM).
REFERÊNCIAS BIBLIOGRÁFICA: ARKEMA. 2012. Hydrogen peroxide: brighten your future with us. Material extraído do site: www.albone.arkemagroup.com.
BACCAN, N.; ANDRADE, J. C.; GODINHO, O. E. S.; BARONE, J. S. 1979. Química Analítica Quantitativa Elementar. São Paulo: Edgard Blücher, 245 p.
CONSOLARO, A.; FRANCISCHONE, L. A.; CONSOLARO R. B. 2011. O clareador dentário atua como co-carcinógeno na mucosa bucal, inclusive quando em dentifrícios e antissépticos: Fundamentos para orientação de pacientes ortodônticos e como evitar seus efeitos indesejáveis. Dental Press Journal of Orthodontics,16: 1-7.
CHRISTIAN, G. D. 1986. Analytical Chemistry. 4th edition. New York: John Wiley & Sons, 676 p.
MEUNIER, B. 1992. Metalloporphyrins as versatile catalysts for oxidation reactions and oxidative DNA cleavage. Chemical Reviews, 92: 1411-1456.
OHLWEILER, O. A. 1981. Química Analítica Quantitativa. 3ª edição. Rio de Janeiro: LTC, v. 2. 226 p.
SCIENTIFIC COMMITTEE ON CONSUMER PRODUCTS - EUROPEAN COMISSION (SCCP). 2007. Opinion on: Hydrogen peroxide, in its free form or when released, in oral hygiene products and tooth whitening products.
VOGEL, A. I. 1989. Vogel’s Textbook of Quantitative Chemical Analysis. Revisado por G. H. Jeffery, J. Bassett, J. Mendham e R. C. Denney. 5th edition. Londres: Longman Scientific & Technical, 877 p.
