ÁREA: Química Analítica
TÍTULO: DESENVOLVIMENTO DE UM PROCEDIMENTO ESPECTROFOTOMÉTRICO PARA DETERMINAÇÃO DE ALUMÍNIO EM ÁGUAS EMPREGANDO HEMATOXILINA.
AUTORES: Fonseca, C.C. (UFGD) ; de Carvalho, J.C. (UFGD) ; Ferreira, G.F.T.M. (UFGD) ; Vieira, H.J. (UFGD)
RESUMO: O presente trabalho propõe um procedimento espectrofotométrico empregando hematoxilina (HMT) como cromóforo para determinação de Al(III) em amostras de águas. Parâmetros químicos como a concentração de HMT, pH e o efeito de surfactantes na formação do complexo HMT-Al(III) foi investigada. Depois de otimizado, o procedimento apresentou uma relação linear entre a absorbância e concentração de Al(III), no intervalo de 2,46x10-6 a 1,23x10-5 mol L-1, com um limite de detecção de 1,11x10-6 mol L-1.
PALAVRAS CHAVES: alumínio(III); hematoxilina; espectrofotometria
INTRODUÇÃO: O Alumínio é o terceiro elemento mais abundante na crosta terrestre, não é costume encontrá-lo como substância elementar, mas em formas combinadas tais como óxidos ou silicatos (VERÍSSIMO et al., 2008; FRANCISCO et al., 2010). Sais contendo Al(III) são usados no tratamento da água, como aditivo elementar e também empregados em formulações farmacêuticas, principalmente para auxiliar no controle de distúrbios gastrointestinais. As Organizações das Nações Unidas estabelece uma concentração de Al(III) de 200 ppb nas águas de abastecimento (ONU, 2003). A ingestão excessiva de Al(III) pode influenciar negativamente o organismo humano, perturbar o metabolismo de cálcio e fosfato e, portanto, prejudicar o sistema ósseo (HOSSEINZADEH et al., 2008). Por isso, há a necessidade do desenvolvimento de procedimentos analíticos para a determinação de Al(III) em águas de abastecimento. Neste trabalho propõe-se a utilização da Hematoxilina como reagente espectrofotométrico na otimização de um prcedimento analítico para determinação de Alumínio(III) em águas empregando surfactantes para acentuar a sensibilidade do procedimento.
MATERIAL E MÉTODOS: Todos os reagentes utilizados foram de grau analítico (Aldrich, Vetec e Carlo Herba), as seguintes soluções foram preparadas em água destilada: solução de HCl 0,01 mol/L, solução de AlCl3 4,0x10-5 mol/L desta foi realizada diluições para o preparo das soluções de trabalho, solução de acetato de amônio 1,0 mol/L, solução de cloreto de Tetrabutilamônio (CTBA) 4 e 1,6 %, solução de brometo de Cetiltrimetilamônio (DTAB) 2,7x10-2 mol/L, solução de Lauril Sulfato de Sódio (LESS) 7,0x10-2 mol/L e solução de Brij-35 8,2x10-3 mol/L. A solução de Hematoxilina 1 % m/v foi preparada pela dissolução de 0,2504 g em 5 mL de álcool etílico em balão volumétrico de 25 mL, sendo completado com água destilada, desta preparou-se uma solução de hematoxilina 0,1%. Na preparação das amostras, 20 mL da amostra de água foi levada a secura em chapa de aquecimento, em seguida adicionado 2,0 mL de HNO3 concentrado e novamente levado à secura na capela. Após resfriamento, adicionou-se 5,0 mL de água e transferiu-se para balão volumétrico de 10 mL, sendo o volume completado com água destilada. As medições experimentais foram realizadas no espectrofotômetro UV-vis Cary, modelo 50 CONC (Varian) em 650 nm, com cubetas de poliestireno de 1,5 mL.
RESULTADOS E DISCUSSÃO: O efeito da concentração de HMT sobre formação do complexo foi estudado empregando uma solução de Al(III) 3,70x10-4 mol/L, e solução de HMT com faixa de concentração variando entre 0,03 a 0,30% m/v. Verificou-se que a sensibilidade não aumenta significativamente para concentrações de HMT acima de 0,200% m/v. Assim, a concentração de HMT 0,133% m/v foi escolhida para a determinação de Al(III), por apresentar valor absoluto de absorbância e ganho de sensibilidade apropriado e garante excesso do complexante no meio reacional. O sistema HMT-Al(III) é estável por cerca de 1 hora. Em seguida, avaliou-se o efeito da variação do pH sobre a absorbância do complexo HMT-Al(III), admitindo-se que em pH elevados ocorre a formação de uma suspensão de hidróxido de alumínio, optou-se pela solução com pH 7,02 para o procedimento geral. O efeito da presença de surfactantes na formação do complexo foi avaliado, verificou-se que apenas o surfactante CTBA promove um aumento de 15% na sensibilidade. Assim, otimizou-se a concentração de CTBA sobre o sinal analítico na faixa de concentração de 0,011 a 0,13 mol/L. Constatou-se que a absorbância do complexo HMT-Al(III) aumentou com elevação da concentração do surfactante até 0,11 mol/L. A partir desta concentração, a absorbância se mantém praticamente constante, sendo assim adotou-se concentração de 0,11 mol/L para posteriores determinações. Sob as condições otimizadas, o procedimento apresentou uma curva analítica (Abs = - 0,0283 + 44192,7[Al(III)]), onde [Al(III)] é mol/L, com uma resposta linear no intervalo de 2,46x10-6 a 1,23x10-5 mol L-1. O limite de detecção determinado foi de 1,11x10-6 mol L-1 (0,03 mg/L). A Figura 1 apresenta a curva analítica para o Alumínio. As recuperações (Tabela 1) variaram de 98 a 110% para Al(III).
FIGURA 1
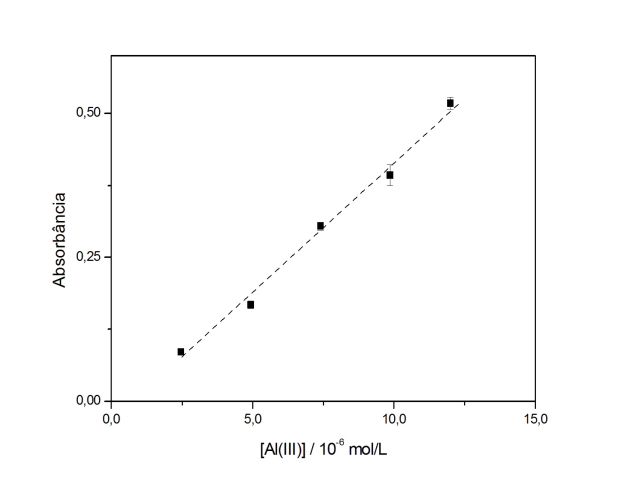
Curva analítica do procedimento proposto para determinação de Alumínio(III).
TABELA 1
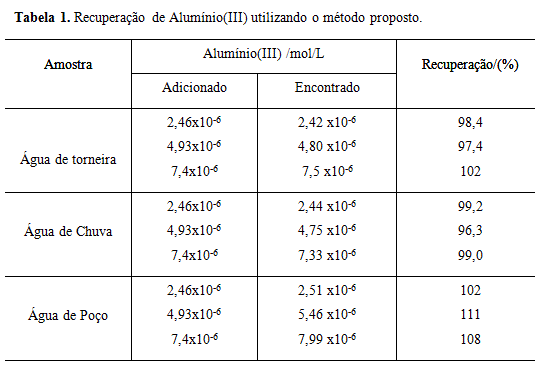
Estudo de recuperação de alumínio(III) nas amostras analisadas utilizando o procedimento proposto
CONCLUSÕES: O método desenvolvido mostrou-se adequado para análise de Al(III) numa faixa de 2,46x10-6 a 1,23x10-5 mol L-1. No efeito do pH, verificou-se que a sua variação altera a absorbância da espécie e que o melhor pH para a análise é próximo de 7. Observou-se que a melhor concentração de HMT 0,133% m/v e que a espécie HMT-Al(III) é instável após 1 hora.
AGRADECIMENTOS: CAPES, PROEX-UFGD
REFERÊNCIAS BIBLIOGRÁFICA: FRANCISCO, B. B.; CALDAS, L. F.; CASSELA, R. J. 2010. Novel spectrophotometric method for the determination of aluminum in soda drinks packed in cans and plastic bottles. Journal of Hazardous Materials, 181: 485-490.
HOSSEINZADEH, R.; MALEKI, R.; MATIN, A. A.; NIKKHAHI, Y. 2008. Spectrophotometric study of anionic azo-dye light yellow (X6G) interaction with surfactants and its micellar solubilization in cationic surfactant micelles. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 69: 1183-1187.
VERÍSSIMO, M. I. S.; GOMES, M. T. S. R. 2008. Aluminium migration into beverages: Are dented cans safe? Science of the Total Environment, 405: 385-388.
