ÁREA: Ambiental
TÍTULO: DEGRADAÇÃO DO FENOL VIA PROCESSOS OXIDATIVOS AVANÇADOS
AUTORES: Guimaraes, G. (UFPE) ; Zaidan, L.E.M.C. (UFPE) ; Benachour, M. (UFPE) ; Silva, V.L. (UFPE)
RESUMO: A importância de detectar a presença de substâncias tóxicas e avaliar seus
impactos ao meio ambiente é reconhecida globalmente, resultando em uma série de
metodologias a serem adotadas. Muitos dos contaminantes são tão tóxicos que podem
causar problemas de saúde em seres humanos em níveis residuais.O fenol prejudica
nossos ecossistemas, acredita-se ser carcinogênico. Os Processo Oxidativos
Avançados (POA) têm-se mostrado eficazes na degradação de compostos orgânicos,
pois geram substâncias, capazes de degradar estes compostos. O presente trabalho
avalia o percentual de degradação do fenol via POA visando à recuperação das águas
produzidas. O sistema aplicado apresentaram resultados bastante satisfatórios,
reduzindo em até 61,43% (H2O2/UV), e 60% (foto-Fenton) do poluente analisado.
PALAVRAS CHAVES: Fenol; Efluentes industriais; processos oxidativos
INTRODUÇÃO: A poluição da água é uma das principais ameaças e desafios que a humanidade
enfrenta hoje. Todos os dias as atividades humanas introduzem substâncias
contaminantes e resíduos em rios, lagos, aqüíferos e oceanos. Esta contaminação
modifica a qualidade da água ambiental, produzindo grandes quantidades de água
que são impróprios para vários usos, incluindo o consumo humano (MOREIRA DEL
RIO, 2011). Dentre todos os poluentes, o fenol e os seus derivados vem se
destacando como contaminantes de principal preocupação devido a sua toxicidade
aguda no meio ambiente. Estes compostos estão presentes nas águas residuais a
partir de muitos processos industriais. Eles têm sido detectadas em resíduos
urbanos e agrícolas (AHMED et al., 2010) em todo o mundo. A exposição a fenol
está relacionado com doenças graves, tais como leucemia e alguns graves
problemas de funcionamento de órgãos humanos.
Uma alternativa para o tratamento destas águas consiste na aplicação dos
processos oxidativos avançados (POA), os quais apresentam como principal
vantagem a capacidade de degradar os compostos orgânicos, levando à redução ou
mesmo à total mineralização da carga orgânica tóxica presentes em efluentes
aquosos, diminuindo assim a emissão de poluentes no meio ambiente ou mesmo
permitindo a recuperação da água para ser utilizada para outros fins (MOTA,
2010). O presente trabalho tem por objetivo avaliar o percentual de degradação
do fenol via POA utilizando reator anular de bancada.
MATERIAL E MÉTODOS: Para a realização deste trabalho foram utilizadas amostras retiradas de
uma solução sintética preparada com fenol (C6H5OH) na concentração de 200
mg.L-1. O Planejamento Fatorial Fracionado envolveu-se 4 variáveis (24-1 mais 3
pontos centrais), obtendo-se como resposta a remoção do fenol. As variáveis
independentes foram: Ferro, peróxido de hidrogênio, pH e tempo.
Análise Cromatográfica
A identificação e quantificação do fenol foi realizada utilizando o equipamento
de Cromatografia Líquida de Alta Eficiência (CLAE) da Shimadzu com uma coluna
C18 de fase reversa (5µm; 4,6 x 250 mm) e detecção UV (SPD-20A) para
comprimentos de onda de 270 nm. A fase móvel consiste em uma solução de água
acidificada com ácido fosfórico e metanol numa razão de (90:10) com fluxo de
0,75 mL.min-1 em modo isocrático. A fase estacionária é composta pelo grupo
octadesyl.
Análise por COT
Para a análise quantitativa do processo de mineralização dos compostos
aromáticos, empregar-se-á a análise de Carbono Orgânico Total (TOC), utilizando
um equipamento de alta sensibilidade (4 μgC.L-1 – 25.000 mgC.L-1), da Shimadzu
modelo TOC-VCSH com capacidade de quantificar os índices de COT; subtraindo-se o
carbono total (CT) e carbono inorgânico (CI).
Reator anular de bancada
Reator fotoquímico anular de bancada de fluxo ascendente. A capacidade do
sistema é de aproximadamente 2,3L. A lâmpada usada no reator é de vapor de
mercúrio de potência 80W (Philips HPLN), a qual a mesma é posicionada ao longo
do eixo longitudinal do reator no interno interior de uma camisa constituída de
quartzo, onde circula água com a finalidade de resfriar a Lâmpada.
O reator é ligado através das mangueiras de silicone onde são conectadas a um
tanque de recirculação constituída de uma bomba interna.
RESULTADOS E DISCUSSÃO: O sistema utilizado foi eficiente na remoção do contaminante, obtendo em até
61,43% de degradação do fenol. Os ensaios que apresentaram melhores resultados
para a degradação do fenol foram realizados para as seguintes condições (pH
entre 2 e 3; adição de 30 mmoL de H2O2 e sem adição de Ferro) e (pH entre 2 e 3;
adição de 30 mmoL de H2O2 e 10 mg.L-1 de Ferro). Esses resultados indicam que o
tanto o processo UV/H2O2 quanto foto-Fenton mostraram-se eficientes para
degradação do fenol apresentando em até 61,43% de remoção do contaminante em 120
minutos e 60,01% em 30 minutos respectivamente, ou seja, ambos experimentos
obtiveram remoções significativas bem próximas o que é corroborado por Kušić et
al. (2006) que afirmam que ambos processos são eficientes para a degradação do
fenol. Conforme Huang et al. (2010), o processo UV/H2O2 não foi eficiente na
remoção do fenol, degradando cerca de 25% em 1 hora, não ocorrendo o mesmo neste
estudo. A análise estatística foi realizada através do software Statistica 8.0.
Esses resultados podem ser melhores visualizados através da análise da Carta de
Pareto (Figura1).
A Carta de Pareto representada pela Figura 1 indica que todos os efeitos
principais foram estatisticamente significativos para 95% de confiança. Como o
efeito do pH apresentou valor negativo (-80,6667), tem-se a indicação que do
nível menor para o nível maior ocorre uma redução da degradação do fenol;
enquanto que os efeitos principais Ferro, H2O2 e Tempo foram positivos,
indicando-se que do nível maior para o nível menor ocorre a redução do
mesmo.Observa-se ainda efeito de interação de dois fatores para pH e ferro.A
análise da Figura 2 indica que uma maior adição de ferro acompanhada do menor
nível de controle do pH (2-3) proporciona uma maior degradação do composto fenol
Figura 1 - Carta de Pareto referente à degradação do fenol
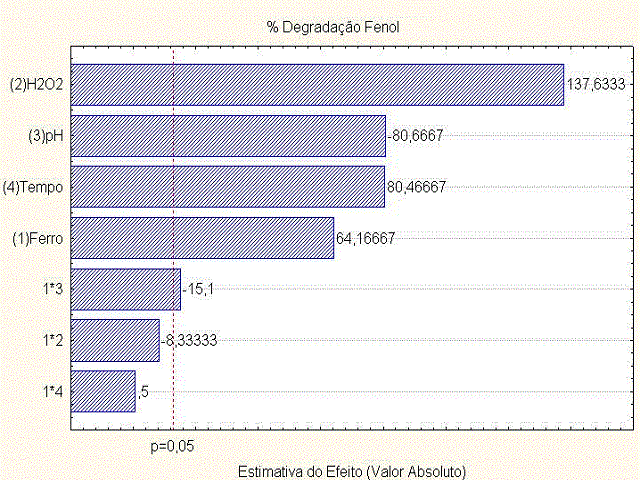
A Carta de Pareto representada pela Figura 1
indica que todos os efeitos principais foram
estatisticamente significativos para 95% de
confiança.
2 - Análise do efeito de interação pH e ferro
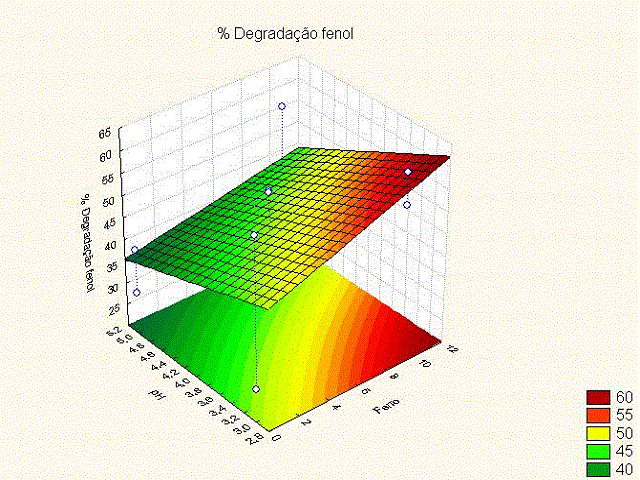
Figura 2 indica que uma maior adição de ferro
acompanhada do menor nível de controle do pH (2-3)
proporciona uma maior degradação do composto fenol.
CONCLUSÕES: As variáveis independentes estudadas no planejamento (Ferro, H2O2, pH e tempo)
foram estatisticamente significativos para 95% de confiança, observando-se ainda
efeito de interação entre dois fatores para: pH e ferro positivos.
Em termos de degradação do foi mostrado que o tratamento da água produzida pelos
processos H2O2 e foto-Fenton apresentou resultados bastante satisfatórios, em
certas condições experimentais, chegando a reduzir 61,43 e 60%, respectivamente.
AGRADECIMENTOS: Agradecimentos ao PRH-28 pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: AHMED, S., RASUL, M.G., MARTENS, W.N., BROWN, R., HASHIB, M.A. Heterogeneous photocatalytic degradation of phenols in wastewater: A review on current status and developments. Desalination 261, 3-18, 2010.
HUANG, Y. ; HUANG. H. T.; CHEN, H. Degradation of phenol using low concentration of ferric ions by the photo-Fenton process. Journal of the Taiwan Institute of Chemical Engineers, 41,699 – 704, 2010.
KUŠIĆ, H.; KOPRIVANAC, N.; BOŽIĆ, A. L.; SELANEC I. Photo-assisted Fenton type processes for the degradation of phenol: A kinetic study. [Journal Hazard. Materials 632–644] Journal of Hazardous Materials, Volume 138, Issue 2, 16 November, Pages 419-420, 2006.
MOREIRA DEL RIO, J. Photocatalytic degradation of phenolic compounds in water: Irradiation and kinetic modeling. Tese de doutorado. The University of Western Ontario. London, Ontario, Canada, 2011.
MOTA, A. L. N. Desenvolvimento de um sistema foto-oxidativo visando aplicação no tratamento de águas produzidas em campos de petróleo. Tese de doutorado, UFRN, Programa de Pós-graduação em Engenharia Química. Natal/RN, Brasil, 2010.
