ÁREA: Ambiental
TÍTULO: ESTUDO DE QUALIFICAÇÃO E QUANTIFICAÇÃO DO CÁDMIO EM MEIO AQUOSO, UTILIZANDO MULTÍMETRO DIGITAL.
AUTORES: Pereira, T. (UNIFOR-MG) ; de Rezende, J.A. (UNIFOR-MG) ; Almeida, A. (UNIFOR-MG)
RESUMO: A água é um recurso natural indispensável para o uso do ser humano, plantas e animais, não devendo por esse motivo, conter elementos danosos aos seres vivos. A determinação de elementos metálicos considerados tóxicos é de grande relevância no monitoramento dos mesmos, principalmente em relação à qualidade das águas. Este trabalho tem por objetivo empregar um multímetro para realizar medidas qualitativas e quantitativas visando avaliar a presença de cádmio em meio aquoso. O trabalho desenvolvido utilizou amostras coletadas em um córrego situado na cidade de Formiga-MG.
PALAVRAS CHAVES: meio aquoso; amperométrica; multímetro
INTRODUÇÃO: O cádmio é um elemento que não existe em quantidades comerciais, sendo então obtido como produto secundário da extração de outros elementos. A maior parte do cádmio produzido é empregada para proteger o aço da corrosão, usado na confecção das barras para reatores nucleares e também em baterias Ni/Cd (Lee. J.D , 1999). O cádmio é extremamente tóxico e, quando ingerido se acumula nos rins, provocando seu mau funcionamento, podendo também substituir o zinco em algumas enzimas, inativando-as e, além disso, é uma fonte de poluição quando inserido ao meio ambiente de forma descontrolada. Há diversos métodos para determinação de metais em meio aquoso sendo a amperometria um deles. A amperometria está baseada na medida de passagem da corrente elétrica entre um par de eletrodos que participam de uma reação de eletrólise (Harris, 2005). Este método oferece vantagens como simplicidade e baixo custo. O estudo foi realizado em amostras sintéticas e posteriormente empregado em águas coletadas em um córrego localizado na cidade de Formiga-MG, próximo ao Centro Universitário de Formiga. O mesmo foi escolhido devido a proximidade com oficinas mecânicas, madeireira e marmoraria.
MATERIAL E MÉTODOS: Estudos iniciais foram realizados com amostras sintéticas de cádmio da seguinte forma: 15 mL de solução de cádmio 0,01 mol/L foram titulados com hidróxido de sódio 0,005 mol/L através de um sistema submetido a uma tensão gerada por uma fonte de 4,5V. Utilizou-se uma bureta para gotejar o hidróxido de sódio (NaOH) no sistema sob agitação magnética e, para aferição da corrente, um multímetro. Da mesma forma, procedeu-se com a amostra.
Amostragem
Definindo-se dois pontos ao longo do córrego e com o auxílio de potes coletores, retirou-se amostras de água no meio do canal.
Determinação de Cd.
As titulações foram realizadas através de um sistema submetido a uma tensão gerada por uma fonte de 4,5V. Utilizou-se uma bureta para gotejar o hidróxido de sódio, sob agitação magnética e, para aferição da corrente, um multímetro.
Foi empregado o sistema amostra (1 e 2) e hidróxido de sódio, como titulado e titulante, respectivamente.
A corrente que flui pela célula, durante a titulação, é monitorada em função do volume do titulante adicionado. Tomando como base o trabalho de (Assumpção et al, 2008) a título de comparação, manteve-se a concentração de cádmio a 0,01 mol/L e de hidróxido de sódio à 0,005 mol/L.
RESULTADOS E DISCUSSÃO: À medida que é adicionada à solução o titulante, ocorre precipitação do cádmio. Consequentemente, o valor aferido da corrente elétrica sofre alteração e tende a diminuir, até obter o valor zero. Este valor indica que não há mais íons de cádmio na solução, ou seja, todo cádmio foi precipitado.
Para as duas amostras não foi notada alteração do valor de corrente elétrica, pois este valor permaneceu em torno de 0,3mA, evidenciando que no local escolhido não houve indícios de contaminação por cádmio, porém existe a presença de outros elementos metálicos. Tal afirmativa é justificada com o experimento que foi realizado em seguida. Num segundo experimento com a amostra do córrego dopada, os valores aferidos para corrente tiveram uma elevação em função da adição de cádmio, indicando a presença de cádmio e comprovando a eficiência na forma de monitorar o elemento com o uso do multímetro.
A Figura 1 exibe as curvas de titulação amperométrica de 20 mL das amostras 1 e 2, e 15 mL de hidróxido de sódio 0,005 mol/L. A figura 2 mostra as curvas de titulação amperométrica de 20 mL das amostras 1 e 2, 5 mL de solução de cádmio 0,01 mol/L e 15 mL de hidróxido de sódio 0,005 mol/L.
Amostras Reais
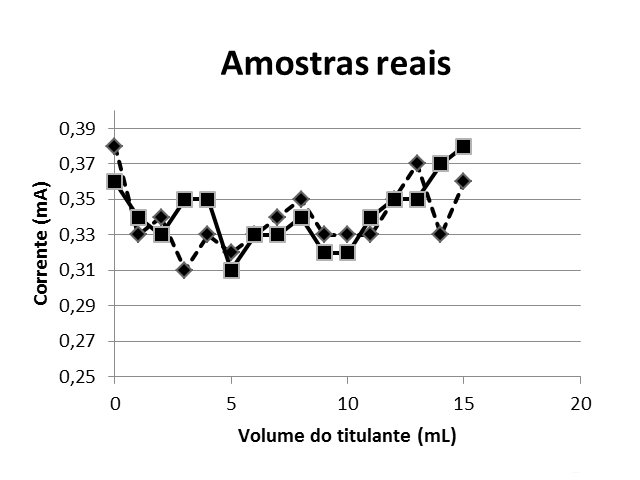
Figura 1: 20 mL das amostras 1 e 2 e 15 mL de hidroxido de sódio 0,005 mol/ L
Amostras Reais com Adição de Cd
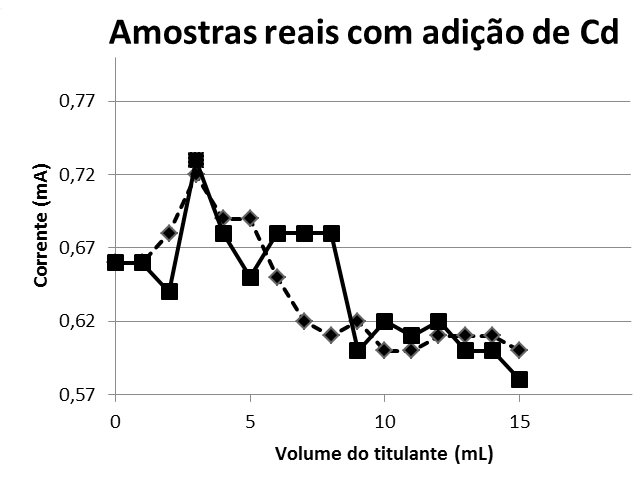
Figura 2: 20 mL das amostras 1 e 2, 15 mL de hidróxido de sódio 0,005 mol/ L e 5 mL de solução de cádmio 0,01 mol/L.
CONCLUSÕES: O método desenvolvido neste trabalho mostra a viabilidade do emprego da reação das amostras com o hidróxido de sódio. È um método de baixo custo, uma vez que os materias utilizados como a fonte, o multímetro e o sistema amperométrico podem ser desenvolvidos no próprio laboratório ou conseguidos no mercado local. E por fim viu-se que para o local escolhido não houve indícios de contaminação pelo elemento cádmio.
AGRADECIMENTOS: A FAPEMIG pela bolsa, a UNIFOR-MG pelo uso dos laboratórios e equipamentos e ao CEPEP.
REFERÊNCIAS BIBLIOGRÁFICA: HARRIS, D.C. Análise Química Quantitativa. 6ª ed. Rio de Janeiro, LTC-S.A, 2005.
LEE, J.D. Química Inorgânica Não Tão Concisa. 5ª ed. São Paulo, Editora Edgard Blucher Ltda, 1999.
ASSUMPÇÃO, H.M.T.; MEDEIROS, A.R.; MADI, A.; FATIBELLO-FILHO, O.; Quim. Nova 2008, Vol 31, No.7, 1743-1746.
