ÁREA: Produtos Naturais
TÍTULO: Composição química e atividade citotóxica do óleo essencial das folhas de Annona vepretorum (Annonaceae)
AUTORES: Pinto, S.B. (UNIVERSIDADE FEDERAL DE SERGIPE) ; Menezes, L.R.A. (UNIVERSIDADE FEDERAL DE SERGIPE) ; Salvador, M.J. (UNIVERSIDADE ESTADUAL DE CAMPINAS) ; Carvalho, J.E. (UNIVERSIDADE ESTADUAL DE CAMPINAS) ; Costa, E.V. (UNIVERSIDADE FEDERAL DE SERGIPE)
RESUMO: O óleo essencial das folhas de Annona vepretorum foi obtido por hidrodestilação
usando um aparelho do tipo Clevenger e analisado por CG-EM e CG-DIC. 21 compostos
representando 98,0% do óleo bruto foram identificados. Os constituintes
majoritários identificados foram: biciclogermacreno (39,06%), espatulenol
(14,65%), α-felandreno (11,48%), (E)-β-ocimeno (8,26%), α-pineno (5,83%), o-cimeno
(5,72%) e germacreno D (5,47%). O óleo essencial demonstrou forte atividade
citotóxica frente a oito linhagens de células tumorais, alguns com valores de TGI
menor que 30 μg/mL. Os melhores resultados foram obtidos contra UACC-62
(melanoma), 786-0 (rim) e NCI-ADR/RES (ovário resistente a múltiplos fármacos),
com valores de TGI de 6,21, 9,84 e 15,36 μg/mL, respectivamente.
PALAVRAS CHAVES: Annona vepretorum; óleo essencial; atividade citotóxica
INTRODUÇÃO: Annona vepretorum Mart. é uma espécie de Annonaceae popularmente conhecida como
araticum. É encontrada no Nordeste brasileiro, particularmente nos Estados da
Bahia e Sergipe. Estudos prévios com esta espécie relatam a identificação de óleos
essenciais com propriedades tripanocida e antimicrobiana (COSTA et al., 2012).
Dando continuidade ao estudo das anonáceas de Sergipe, em particular de A.
vepretorum, descrevemos neste trabalho a composição química do óleo essencial das
folhas (TABELA 1), bem como o resultado da sua atividade citotóxica em onze
linhagens de células tumorais humanas (TABELA 2).
MATERIAL E MÉTODOS: As folhas de A. vepretorum foram coletadas em março de 2012 no Município de Poço
Redondo, Sergipe, Brasil. O óleo essencial das folhas secas por 24 h em estufa
de ar-circulante a 40 °C de A. vepretorum foi obtido por hidrodestilação por 3
h, usando um aparelho de tipo Clevenger. O óleo essencial foi seco sob sulfato
de sódio anidro e o teor do seu percentual foi calculado com base no peso do
material vegetal seco. Parte do óleo essencial foi analisado por CG-DIC e CG-EM,
enquanto a outra parte foi submetida ao ensaio de atividade citotóxica
utilizando onze linhagens de células tumorais humanas de acordo com a
metodologia de Skehan et al. (1990). As condições de análise do CG-EM e CG-DIC
foram: coluna capilar de sílica fundida DB-5MS (30 m X 0,25 mm X 0,25 µm)
composta por 5%-fenil-95%-dimetilpolisilioxano; gás de arraste Hélio (99.999%)
com fluxo constante de 1,0 mL/min; temperatura programada mantendo 40 °C por 4,0
min, seguido de um aumento de 4 °C/min até atingir a temperatura de 240 °C, com
posterior aumento de 10 °C/min até atingir a temperatura de 280 °C, a qual se
manteve por 2,0 min. O volume de injeção foi de 0,5 μL da amostra solubilizada
em diclorometano (CH2Cl2) com taxa de partição de 1:50; a
temperatura do injetor e detector foi de 250 °C e 280 °C, respectivamente; para
a obtenção dos espectros de massas foi utilizado um detector de captura iônica
operando por impacto eletrônico e energia de impacto de 70 eV com um intervalo
de 0,5 s e fragmentos de 40 a 550 Da. A identificação dos compostos foi
realizada através de comparação dos índices de retenção (IR) e espectros de
massas obtidos com banco de espectros NIST e WILEY, além de outros espectros da
literatura (VAN DEN DOOL & KRATZ, 1963; ADAMS, 2007).
RESULTADOS E DISCUSSÃO: Através da análise por CG-EM foi possível identificar 21 compostos compreendendo
cerca de 98,0% do óleo bruto, sendo os sesquiterpenos os constituintes
majoritários com 64,82% (TABELA 1). Os compostos majoritários identificados
foram: biciclogermacreno (39,06%), espatulenol (14,65%), α-felandreno (11,48%),
(E)-β-ocimeno (8,26%), α-pineno (5,83%), o-cimeno (5,72%) e germacreno D
(5,47%). Quando comparado com os dados descritos por Costa et al. (2012)
observou-se pouca variação entre os componentes identificados. Entretanto,
alguns compostos identificados tais como, o-cimeno, limoneno, linalol, δ-
elemeno,α-copaeno, deidro-aromadendreno e δ-cadineno são descritos pela primeira
vez na espécie. Esta variação pode ser explicada pelas diferencas climáticas,
bem como pela sazonalidade.
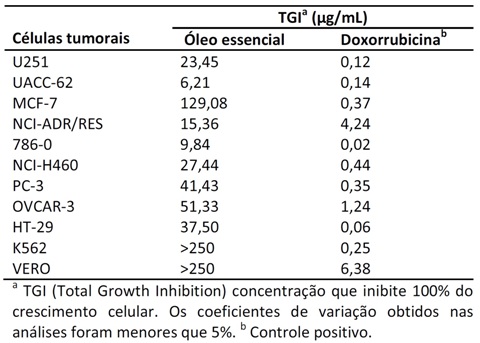
O óleo essencial de A. vepretorum demonstrou potente atividade citotóxica contra
oito linhagens de células tumorais dentre dez avaliadas (TABELA 2), alguns com
valores de TGI “Total Growth Inhibition” abaixo de 30 μg/mL. Os melhores
resultados foram obtidos contra UACC-62 (melanoma), 786-0 (rim) e NCI-ADR/RES
(ovário resistente a múltiplos fármacos), com valores de TGI de 6,21, 9,84 e
15,36 μg/mL. Para as linhagens de células VERO (linhagem de célula não
cancerígena; controle) o óleo essencial não apresentou citotoxidade (TGI > 250
μg/mL). Esses resultados indicam que A. vepretorum é uma fonte promissora de
compostos biologicamente ativos com propriedades citotóxicas e estimulam sua
investigação em ensaios in vivo.
Tabela 1 - Composição química do óleo essencial
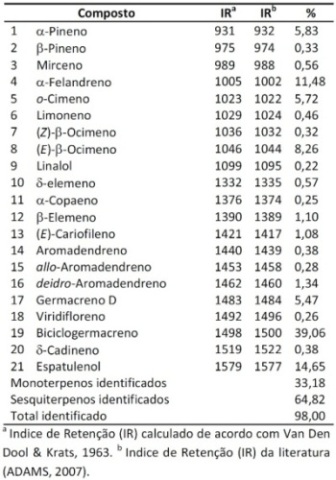
Tabela 2 - Atividade citotóxica do óleo essencial de A. vepretorum
CONCLUSÕES: A análise do óleo essencial de A. vepretorum permitiu a identificação de sete
compostos descritos pela primeira vez na espécie. Os compostos identificados estão
de acordo com os descritos em espécies de Annonaceae. O óleo essencial apresentou
forte atividade citotóxica contra oito linhagens de células tumorais, indicando
que A. vepretorum é uma fonte promissora de compostos biologicamente ativos, o que
sugere a continuação do seu estudo em ensaios in vivo.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ADAMS, R. P. 2007. Identification of essential oil components by gas chromatography/mass spectrometry. Carol Stream, IL: Allured Publishing Corporation.
COSTA, E. V.; DUTRA, L. M.; NOGUEIRA, P. C. L.; MORAES, V. R. S.; RIBEIRO, L. H. G.; GADELHA, F. R. 2012. Essential oil from the leaves of Annona vepretorum: chemical composition and bioactivity. Natural Product Communications 7(2): 265-266.
SKEHAN, P.; STORENG, R.; SCUDIERO, D.; MONKS, A.; MCMAHON, J.; VISTICA, D.; WARREN, J.T.; BOKESCH, H.; KENNEY, S.; BOYD, M.R. 1990. New colorimetric cytotoxicity assay for anticancer-drug screening. Journal of the National Cancer Institute 82: 1107-1118.
VAN DEN DOOL, H.; KRATZ, P.D. 1963. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography. Journal of Chromatography 11: 463-471.
