ÁREA: Produtos Naturais
TÍTULO: Ação de Lectinas de Croton campestris sobre fungos fitopatogênicos do gênero Fusarium.
AUTORES: Silva, D.G.R. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Cunha, M.C. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Melo, A.S. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Simões, S.S. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Nascimento, K.T.O. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Costa, J.A. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL) ; Napoleão, T.H. (DEPTO. DE BIOQUÍMICA,CCB,UFPE,PE,BRASIL) ; Paiva, P.M.G. (DEPTO. DE BIOQUÍMICA,CCB,UFPE,PE,BRASIL) ; Sá, R.A. (CENTRO ACADÊMICO DO AGRESTE, UFPE,PE,BRASIL)
RESUMO: Lectinas apresentam ação contra insetos e fungos. O trabalho objetivou extrair
lectina de C.campestris, planta do agreste pernambucano, e investigar a sua ação
sobre os fusarium oxysporum, moniliforme e verticilloides. 24g de farinha das
folhas de C. campetres em 480 ml de NaCl 0,15M, foram utilizado na preparação do
extrato (EB10). A presença de lectina em EB10 foi detectada através da AH. O
EB10 teve uma AHE de 7,728UH/mL. As proteínas de EB10 foram precipitadas com
(NH4)2SO4. A fração 40% (PF2) foi à escolhida para a purificação da lectina. PF2
foi aplicada em coluna de quitina equilibrada com NaCl 0,15M. O pico protéico
(PII), eluído com C2H4O2 a 1,0 M, foi definido como a lectina de C. campestris.
EB10, PF2 e PII apresentaram atividade antifúngica contra todas as espécies de
Fusarium.
PALAVRAS CHAVES: Croton campestris; Lectinas; Fusarium
INTRODUÇÃO: Croton campestris é uma planta pertencente à Família Euphorbiaceae, uma das mais
extensas famílias de fanerógamos (CRONQUIST, 1981). É uma família cosmopolita
(RANDAU, 2004). O gênero Croton detém expressiva relevância econômica,
alicerçada
em seu conteúdo de óleos essenciais e diversos bioativos como terpenos,
flavonóides
e alcalóides. As espécies desse gênero são empregadas com frequência na medicina
popular como depurativos enérgicos, demonstrando mesmo algumas propriedades
terapêuticas comprovadas. Os estudos existentes centrados em espécies de Croton
são
ainda escassos e dizem respeito às áreas de fitoquímica e farmacologia (ABREU et
al., 2001).
O termo lectina originado do latim, que significa selecionado, refere-se à
habilidade dessas proteínas ligarem-se seletivamente e reversivelmente a
carboidratos. Em vegetais as lectinas são frequentemente isoladas de sementes,
folhas e etc. Muitas hipóteses sobre o papel fisiológico das lectinas foram
especuladas devido à ocorrência de lectinas em micro-organismos, animais e em
plantas, mas admite-se que a função primária das lectinas seja a de
reconhecimento
de carboidratos. Lectinas vegetais podem desempenhar importantes papéis tais
como
proteínas de reserva, no mecanismo de defesa contra microrganismos
fitopatogênicos,
insetos e animais predadores afetando o crescimento e desenvolvimento de insetos
e
apresentando atividades tóxicas em animais herbívoros. As lectinas, por terem a
habilidade de se ligar a mono e oligossacarídeos, apresentam uma variedade de
efeitos biológicos. Alguns destes efeitos servem como base para a aplicação de
lectinas na investigação de problemas químicos e biológicos tais como ação
contra
insetos, fungos, bactérias e inibição do crescimento de células tumorais.(LIS &
SHARON, 1986).
MATERIAL E MÉTODOS: 24g de farinha das folhas de C. campestris em 480 ml de NaCl 0,15M, foram
utilizado na preparação do extrato (EB10). A presença de lectinas em EB10 foi
detectada através do ensaio de atividade hemaglutinante (AH). A atividade
lectínica de EB10 foi realizada em placas de microtitulação. Foram colocados
50µl de NaCl 0,15M em cada poço; em seguida, foram adicionados ao segundo poço
50 µl da amostra a ser avaliada. Após uma diluição serial, 50µl de eritrócitos
de coelhos foram adicionados em todos os poços e as placas foram incubadas por
45 min. A AH correspondeu ao inverso da maior diluição (título -1) na qual ainda
se observou a aglutinação total dos eritrócitos. Esta atividade está relacionada
à especificidade e afinidades dos sítios de ligação das lectinas a carboidratos
presentes nas paredes dos eritrócitos.
EB10 foi avaliado quanto à presença de proteínas por espectrofotometria. A etapa
inicial de purificação foi realizada com o fracionamento das proteínas de EB10
através da adição de Sulfato de Amônia. Em seguida, o precipitado (PF2) foi
avaliado em presença de carboidratos. PF2 foi aplicado em coluna de quitina
equilibrada com NaCl 0,15M. O pico protéico ativo (PII) foi eluído com Ácido
acético 1M. A avaliação da estabilidade térmica de EB10, PF2 e PII foi efetuada
de acordo com SHIOMI et al. (1979).
Para o ensaio antifúngico, baseado no método de CUNICO et al. (2004), foram
utilizados os fungos, F.oxysporum F. moniliforme F. verticillioides, obtidos do
Departamento de Micologia, Universidade Federal de Pernambuco, Brasil.
RESULTADOS E DISCUSSÃO: O EB10 apresentou 7,0 mg/mL de proteínas e uma atividade hemaglutinante
específica (AHE) de 7,728UH/mL. AHE foi determinada pela razão AH/concentração
de proteínas (mg/mL).
No processo de purificação parcial de lectina do extrato de C. campestris, a
fração 40%, (PF2) de 6,0 mg/mL de proteínas, apresentou uma melhor AHE (428,09)
e foi à escolhida para a purificação da lectina. A AH de PF2 foi parcialmente
inibida por N-acetilglicosamina e pelas glicoproteínas fetuína, ovoalbumina,
tireoglobulina e azocaseína. A inibição com N-acetilglicosamina é um indicativo
para purificação da lectina através de cromatografia de afinidade em colunas de
quitina. PF2, dialisado contra água destilada e NaCl 0,15 M foi aplicada em
coluna de quitina. O pico proteico (1,0 mg/mL de proteínas) ativo (PII) eluído
com ácido acético 1,0 M foi definido como a lectina de C. campestris (Figura 1).
A AH de EB10, PF2 e PII (100 g/mL de cada amostra) foram avaliadas a
diferentes temperaturas e o ensaio indicou que a AH das amostras proteicas são
termossensíveis, perdendo totalmente sua a AH após aquecimento a 50 ºC.A
atividade antifúngica de EB10, PF2, PII (lectina) C. campestris foi detectada
com 0,7mg, 0,6mg e 0,1mg do extrato, fração e PII, respectivamente. Os
resultados indicam a capacidade da proteína de inibir o crescimento dos fungos
fusarium oxysporum e F. moniliforme. A lectina da Myracrodruon urundeuva (Sá,
2008) também inibiu o crescimento de fungos do gênero fusarium. O que nos revela
um bioativo útil no controle de pragas que atacam plantações.
Figura 1
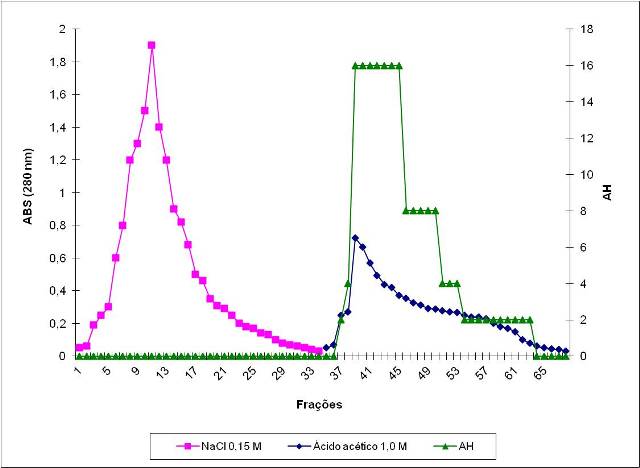
Cromatografia de PF2 em coluna de quitina. O suporte
foi equilibrado com NaCl 0,15M foram coletadas
PII(lectina)após eluição com Ácido acético 1M.
Tabela 1
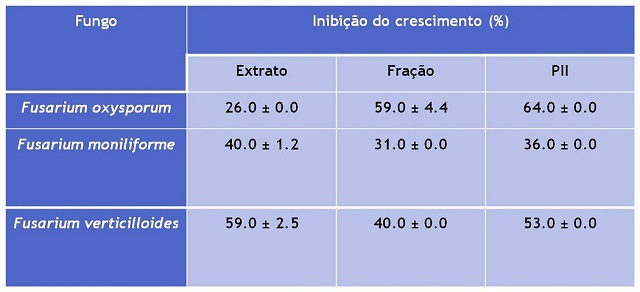
Atividade Antifúngica do extrato salino, Fração e
Pico Ativo.
CONCLUSÕES: O método de extração do bioativo foi realizado em repouso. A fração proteica foi
inibida com N-acetilglicosamina, que estimulou a purificação da lectina (PII) em
cromatografia de matriz quitina. EB10, PF2, PII (lectina) C. campestris inibiram o
crescimento dos fungos fitopatogênicos.
A lectina de Croton campestris é termosensível perdendo totalmente sua AH após o
crescimento à 50ºC.
AGRADECIMENTOS: Ao Laboratório de Química da Universidade Federal de Pernambuco-campus Agreste;
Ao Laboratório de Glicoproteínas da UFPE-campus Recife
REFERÊNCIAS BIBLIOGRÁFICA: ABREU, A. S.; BARBOSA, P. S.; MÜLLER, A. H. & GUILHON, G. M. S. P.; Constituintes químicos do caulee das cascas do caule de Croton pullei var Glabrior (Euphorbiaceae). Revista Virtual de iniciação CientíficaUFPA, v. 1, n 2, p. 1-9, 2001.
CRONQUIST, A. An integrated system of classification of flowering plants. New York: Columbia Universisy Press, 1981.
RANDAU, K. P.; FLORÊNCIO, D. C.; FERREIRA, C. P.; XAVIER, H. S. Estudo farmacognóstico de Croton rhamnifolius H.B.K. e Croton rhamnifolioides Pax & Hoffm.(Euphorbiaceae). Revista Brasileira de Farmacognosia, V.14, n.2, p.89-96,2004.
SÁ,R.A.; Tese de Doutorado, Universidade Federal de Pernambuco, Brasil, 2008.
