ÁREA: Nanociência e Nanotecnologia
TÍTULO: Estudo espectroscópico sobre o efeito de membranas modelo sobre a auto-organização molecular de um peptídeo racionalmente projetado sensível ao pH
AUTORES: Amaral, G.C. (UNIVERSIDADE ESTADUAL DE SANTA CRUZ) ; Costa, A.R. (UNIVERSIDADE ESTADUAL DE SANTA CRUZ) ; Cilli, E.M. (UNIVERSIDADE ESTADUAL PAULISTA) ; Salay, L.C. (UNIVERSIDADE ESTADUAL DE SANTA CRUZ)
RESUMO: Usamos FTIR para estudar a interação do peptídeo P11-4, que se auto-organiza em função do pH, com membranas lipídicas. Na faixa de pH 6-8 estudada percebe-se tanto características espectrais que reportam a presença de peptídeos com conformação folha beta antiparalela (bandas em 1619 cm-1 e 1680-1685 cm-1), como características espectrais que reportam a existência de estruturas peptídicas desordenadas banda (bandas em torno de 1644 cm-1). Pode-se verificar que em pH 6.0 há pouco efeito dos dois tipos de membranas lipídica sobre o P11-4, enquanto que em pH 8.0 a membrana eletricamente neutra (DPPC) preveniu a desestruturação das nanoestruturas formadas pelo peptídeo, para a membrana negativamente carregada (DPPG) o peptídeo se desestruturou passando a se comportar como um fluído isotrópico.
PALAVRAS CHAVES: peptídeos auto-organizáve; membranas modelo; nanomateriais
INTRODUÇÃO: Uma abordagem extremamente interessante e promissora em nanotecnologia é o da produção de peptídeos racionalmente desenhados auto-organizáveis. Tais peptídeos estão sendo produzidos e já sendo utilizados em aplicações nanotecnológicas (Aggeli et al, 1997a,b; Aggeli et al., 2001; Zhang, 2003; Rajagopal e Schneider, 2004; Reches e Gazit, 2006; Zhao et al., 2010). Uma característica comum a esses peptídeos é que são anfifílicos, ou seja, contém regiões hidrofílicas e hidrofóbicas. Eles têm sido explorados como nanobiomateriais em aplicações que vão desde gene controlado e liberação de drogas, nanofabricação, biomineralização, e engenharia de tecidos. No entanto, para que estas aplicações em diversos setores da nanomedicina e da nanobiotecnologia sejam factíveis é necessário que haja um conhecimento detalhado da interação desses peptídeos com a parede da membrana celular. Esse conhecimento em nível molecular é possível através do uso de sistemas biomiméticos de membranas celulares, as chamadas membranas modelo (Salay et al., 2009, 2004; Salay e Carmona-Ribeiro, 1998; Jelinek e Kolusheva, 2005). Além disso, tais sistemas biomiméticos são eles próprios sistemas moleculares auto-organizáveis, e a interação desses peptídeos racionalmente projetados com esses sistemas podem levar a novas nanoestruturas supramoleculares. O objetivo desse trabalho foi o de caracterizar a interação do peptídeo sintético P11-4, cujo grau de auto-organização molecular responde ao pH. Em pH < 3 o P11-4 forma um gel, e em valores de pH crescentes sua estrutura vai ficando menos organizada, passando por diversas fases até tornar-se um fluído isotrópico em pH ≥ 7 (Aggeli et al., 2003). Empregou-se espectroscopia FTIR para verificar o efeito de bicamadas lipídicas sobre a auto-organização do peptídeo
MATERIAL E MÉTODOS: O P11-4 (CH3CO-Q-Q-R-F-E-W-E-F-E-Q-Q-NH2) foi sintetizado manualmente de acordo ao padrão N-alfa-Fmoc com estratégia de proteger seus grupos (Atherton e Sheppard, 1989). Soluções com tampão PBC (Fosfato-Borato-Citrato) 5mM, em diferentes pH’s (6.0 e 8.0) usadas para a dissolução de lipídeos ou peptídeo. Os lipídeos utilizados foram o DPPC (dipalmitoilfosfatidilcolina) e o DPPG (dipalmitoilfosfatidilglicerol). O lipídeo foi dissolvido em 200 μl clorofórmio (DPPC ou em 200 μl clorofórmio/metanol (1:1) (DPPG,) depois feito o vortex, e posteriormente a solução era levada para o SpeedVac por 2 horas para a evaporação do solvente. Posteriormente o lipídio foi resuspendido em 200 μl da solução do peptídeo previamente solubilizado em D2O em pH definido (6.0 ou 8.0). As razão peptídeo/lipídio foi de 0,05. O vortex foi utilizado para solubilizar e homogeneizar a solução e está foi deixada em banho maria em uma temperatura de 60ºC por 24h (Boden et al., 1996). Espectroscopia de infravermelho por transformada de Fourier (FTIR) no modo transmissão foi utilizada para determinar a estrutura secundária bem como as mudanças conformacionais do peptídeo. Todos os espectros foram gravados a temperatura ambiente com espectrômetro FTIR da Perkin-Elmer Spectrum 400 MIR/NIR utilizando uma cela deCaF2. Cada espectro foi uma acumulação de 10 varreduras com uma resolução de 4 cm-1.
RESULTADOS E DISCUSSÃO: Devido ao grande potencial do peptídeo P11-4 como elemento formador de biomateriais nanoestruturados investigou-se o efeito de membranas lipídicas modelo, que são sistemas biomiméticos que “imitam” a parede de membranas celulares sobre o P11-4. Foi utilizado o DPPC um lipídio com um grupo cabeça (PC) que é característico de células de mamíferos e o DPPG com um grupo cabeça (PG) que é característico de células bacterianas. Utilizamos a região da amida I (1700-1600 cm-1) para caracterizar a conformação dos peptídeos. Nos pHs estudados tanto características espectrais que reportam a presença de peptídeos com conformação folha beta antiparalela (1619 cm-1 e 1680-1685 cm-1), como características espectrais que reportam a existência de estruturas peptídicas desordenadas (1644 cm-1) se fazem presente. Na figura 1 (pH 6.0) o peptídeo está mais organizado e formando estruturas supramoleculares fibrilares, comportando-se como um fluído nemático praticamente não há diferença entre os espectros para DPPC e DPPG. Na figura 2 (pH 8.0) vemos diferenças evidentes, com o P11-4 mantendo a conformação folha beta antiparalela na presença de membranas de DPPC, indicando que esse lipídio previne a desestruturação do peptídeo mesmo em pH elevado. Na presença de DPPG predomina a forma monomérica e não estruturada, comportando-se como um fluído isotrópico. Em pH 8.0 o P11-4 apresenta uma carga líquida negativa, de modo que ele ainda pode interagir com a parte positiva do grupo cabeça zwiteriônico (PC), e portanto mantém certo nível de estruturação e organização, enquanto na presença do DPPG, cujo grupo cabeça (PG) é negativamente carregado ocorre repulsão entre o peptídeo e a membrana.
Figura 1
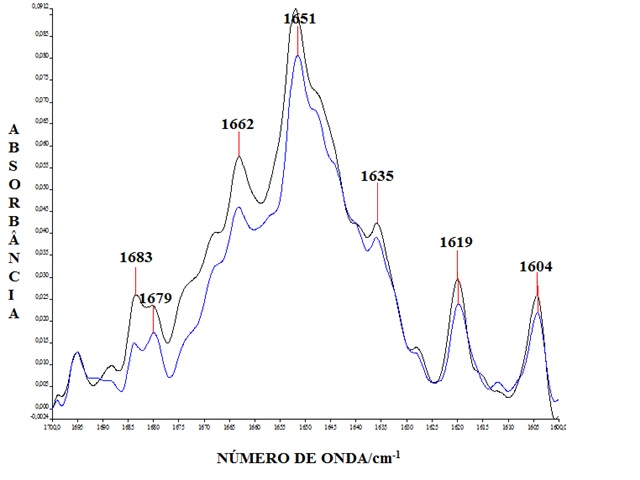
Espectro de FTIR do P11-4 em pH 6.0 na presença de DPPC (Preto) e de DPPG (Azul)
Figura 2
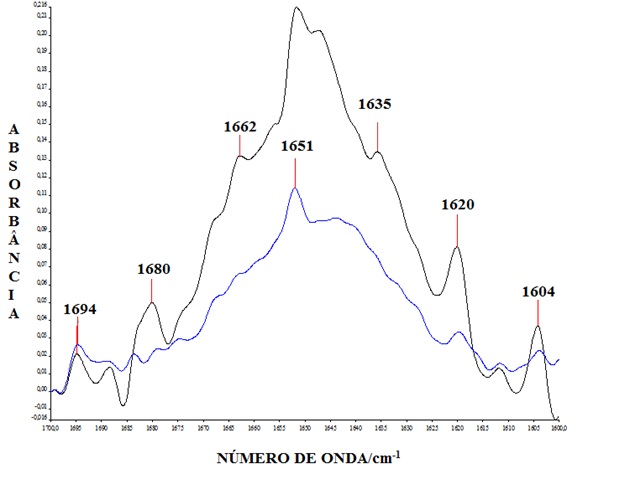
Espectro de FTIR do P11-4 em pH 8.0 na presença de DPPC (Preto) e de DPPG (Azul)
CONCLUSÕES: Os resultados mostraram que a auto-organização molecular do peptídeo P11-4 pode ter seu comportamento modulado também por membranas lipídicas formadas por lipídios distintos, tais como o DPPC e o DPPG, com cabeças polares características de células de mamíferos e de bactérias, respectivamente. Tais resultados têm implicações relevantes em termos de biomateriais nanoestruturados, pois o P11-4 necessariamente em testes biológicos e biomédicos terá que interagir com células vivas compostas por membranas lipídicas.
AGRADECIMENTOS: Ao CNPq pelo apoio. G.C. Amaral agradece a FAPESB pela bolsa de mestrado, A.R. Costa agradece a UESC pela bolsa de IC e E.M Cilli agradece ao CNPq pela bolsa PQ
REFERÊNCIAS BIBLIOGRÁFICA: Aggeli, A.; Bell, M.; Carrick, L.M.; Fishwick, C.W.G.; Harding, R.; Mawer, P.J.; Radford, S.E.; Strong, A.E.; Boden, N. 2003. pH as a Trigger of Peptide β-Sheet Self-Assembly and Reversible Switching between Nematic and Isotropic Phases. Journal of the American Chemical Society. 125: 9619–9628.
Aggeli, A.; Bell, M.; Boden, N.; Keen, J.N.; Knowles, P.F.; McLeish, T.C.B.; PitkeathlyI, M.; Radford, S.E. 1997. Responsive gels formed by the spontaneous self-assembly of peptides into polymeric beta-sheet tapes. Nature. 386: 259-262.
Aggeli, A.; Bell, M.; Boden, N.; Keen, J.N.; McLeish. T.C.B.; Nyrkova. I.; Radford, S. E.; Semenov, A. 1997. Engineering of peptide β-sheet nanotapes. 1997. Journal of Materials Chemistry 7:1135-1145.
Aggeli, A.; Nyrkova, I.A.; Bell, M.; Harding, R., Carrick, L.; McLeish, T.C.; Semenov; A.N.; Boden, N. Hierarchical self-assembly of chiral rod-like molecules as a model for peptide beta -sheet tapes, ribbons, fibrils, and fibers. 2001. Proceedings of the National Academy of Sciences of USA. 98:11857-11862.
Atherton, E.; Sheppard, .R.C. 1989. Solid Phase Peptide Synthesis: A Practical Approach. Oxford University Press, U.K.
Jelinek, R.; Kolusheva, S. 2005. Membrane interactions of host-defense peptides studied in model systems. Current Protein and Peptide Science. 6: 103-114
Rajagopal, K.; Schneider, J.P. 2004. Self-assembling peptides and proteins for nanotechnological applications. Current Opinion in Structural Biology. 14: 480-486.
Reches, M.; Gazit, E. 2006. Molecular Self-Assembly of Peptide Nanostructures: Mechanism of Association and Potential Uses. Current Nanoscience. 2: 105-111.
Salay, L.C.; Carmona-Ribeiro, A.M. 1998. Synthetic Bilayer Wetting on SiO2 Surfaces. Journal of Physical Chemistry B. 102: 4011-4015.
Salay, L.C.; Qi, W.; Keshet, B.; Tamm, L.K. ; Fernandez, E.J. 2009. Membrane Interactions of a Self-Assembling Model Peptide that Mimics the Self-Association, Structure and Toxicity of Abeta(1-40). Biochimica et Biophysica Acta. Biomembranes. 1788: 1714-1721.
Salay, L.C.; Procopio, J.; Oliveira, E.; Nakaie, C.R.; Schreier, S. 2004. Ion-Channel Like Activity of the Antimicrobial Peptide Tritrpticin in Planar Lipid Bilayers. FEBS Letters. 565: 171-175.
Zhang, S. 2003. Fabrication of novel biomaterials through molecular self-assembly. Nature Biotechnology. 21: 1171-1178.
Zhao, X.; Pan, F.; Xu, H.; Yaseem, M.; Shan, H.; Hauser, C.A.E.; Zhang, S.; Lu, J.R. 2010. Molecular self-assembly and applications of designer peptide amphiphiles. 2010. Chemistry Society Review. 39: 3480-3498
