Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Orgânica
TÍTULO: ATIVIDADE CITOTÓXICA DE UMA NOVA SÉRIE DE 3-ARIL-5-PENTIL-1,2,4-OXADIAZÓIS
AUTORES: de Freitas Filho, J.R. (UNIVERSIDADE FEDERAL RURAL DE PERNAMBUCO) ; Rufino Freitas, J.C. (UNIVERSIDADE FEDERAL DE CAMPINA GRANDE) ; Rufino Freitas, J.J. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Gadelha Militão, G.C. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Norberto da Silva, P.B. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Pereira da Silva, L. (UNIVERSIDADE FEDERAL DE CAMPINA GRANDE)
RESUMO: Neste trabalho é descrito a avaliação da atividade citotóxica in vitro de seis 3-(aril)-5-(n-pentil)-1,2,4-oxadiazóis obtido a partir da reação ésteres de ácidos carboxílicos e arilamidoximas apropriadas, na presença de carbonato de potássio. A atividade citotóxica foi realizada com linhagens tumorais, HT29 (carcinoma de cólon - humano), HL60 (leucemia promielocítica) e NCI H-292 (câncer de pulmão– humano) obtidas do Banco de células do Rio de Janeiro. A atividade antiproliferativa foi avaliada contra três linhas celulares humanas diferentes, onde apenas os compostos de 1c e 1f exibiram atividade antiproliferativa moderada contra linhas de células cancerosas HL-60 com valores de IC50 de 42,1 a 28 µM, respectivamente
PALAVRAS CHAVES: 1,2,4-Oxadiazóis; amidoxima; Atividade citotóxica.
INTRODUÇÃO: Os oxadiazóis têm recebido considerável atenção desde o final da década de 50 devido a sua aplicabilidade em diversas áreas. Esta classe de compostos apresenta um pequeno caráter aromático, devido a sua estrutura anelar possui três heteroátomos (O, N, N) e duas ligações duplas.1 1,2,4-oxadiazóis são compostos que têm atraído a atenção de muitos pesquisadores devido à sua ampla gama de atividades biológicas, mas especificamente nas avaliações farmacológicas.2 Na década de 60, pelo menos três oxadiazóis ganharam popularidade como drogas terapêuticas: a oxolamina3 e a libexina,4 que apresentam ação antitussígena, e o irrigor,3 que tem ações vasodilatadoras das artérias coronárias e anestésico local. Kumar e colaboladores prepararam uma série de 1,2,4-oxadiazóis 3,5-dissubstituídos com atividade anticâncer.5 No referido trabalho, foram sintetizados novos 1,2,4-oxadiazóis e seus bioisósteros, 1,3,4-oxadiazol e 1,3,4-tiadiazol, com atividade anticâncer frente a linhagens de células cancerosas humanas relacionadas aos cânceres de próstata, de mama e do pâncreas. Neste trabalho, descrevemos a avaliação da atividade citotóxica in vitro de seis 3-(aril)-5-(n-pentil)-1,2,4-oxadiazóis (3a-f) em três linhagens de células tumorais.
MATERIAL E MÉTODOS: A atividade citotóxica foi realizada com linhagens tumorais, HT29 (carcinoma de cólon - humano), HL60 (leucemia promielocítica) e NCI H-292 (câncer de pulmão– humano) obtidas do Banco de células do Rio de Janeiro, tendo sido cultivadas em meio RPMI 1640 ou DMEN, suplementados com 10 % de soro fetal bovino e 1 % de antibióticos, mantidas em estufa a 37 C e atmosfera contendo 5% de CO2. O método MTT usado, é um método colorimétrico baseada na conversão do sal 3-(4,5-dimetil-2-tiazol)-2,5-difenil-2-H-brometo de tetrazolium (MTT) em azul de formazan, a partir de enzimas mitocondriais presentes somente nas células metabolicamente ativas. O estudo citotóxico pelo método do MTT permite definir facilmente a citotoxicidade, mas não o mecanismo de ação.6 As células foram plaqueadas na concentração de 1 x 105 células/mL. As substâncias previamente dissolvidas em DMSO foram diluídas em série no meio RPMI para obtenção das concentrações finais e adicionadas em placa de 96 poços (100μL/ poço). As placas foram incubadas por 72 horas em estufa a 5% de CO2 a 37C. Em seguida, foram adicionados 25 L da solução de MTT (sal de tetrazolium), e as placas foram incubadas por 3h. A absorbância foi lida após dissolução do precipitado com DMSO puro em espectrofotômetro de placa a 595nm.
RESULTADOS E DISCUSSÃO: : A síntese dos 3-(aril)-5-(n-pentil)-1,2,4-oxadiazóis (3a-f), foi mediada por forno de microonda doméstico e consistiu em reagir as arilamidoximas 1a-f,separadamente, com pentanoato de metila e K2CO3, sem utilização de solvente (esquema 1). A metodologia empregada forneceu os produtos rapidamente, com duração de 8 minutos e bons rendimentos (80-85%).
As estruturas dos compostos 3a-f foram elucidadas através da análise IV, RMN 1H e 13C. A atividade antiproliferativa dos compostos 3a-f foi avaliada utilizando um MTT assay4 contra três linhas celulares humanas: NCI H292 (carcinoma do pulmão), HL-60 (leucemia pró-mielocítica) e HT29 (carcinoma do cólon). De acordo com dados da Tabela 1, nota-se os compostos 3c e 3f exibiram uma atividade de citotoxicidade moderada, contra linhas de células cancerosas HL-60, com valores de IC50 de 42,1 a 28 µM, respectivamente. A explicação da atividade citotóxica, apenas em HL-60 linhagens de células cancerosas é devido a este tipo de linha celular ser sensível ao estresse oxidativo, portanto, apresentam baixo nível de defesa antioxidante.5 Em relação aos compostos 3a-b, 3a-e não foi observada atividade antiproliferativa contra as três linhas de células humanas estudadas, no entanto, este estudo demonstra o potencial inicial desta classe de compostos, uma vez que os compostos de 3c e 3f exibiram uma atividade moderada.
Figura 1
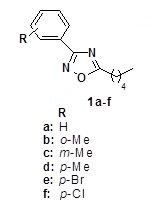
Estruturas dos compostos analisados 1a-f
Tabela 1.
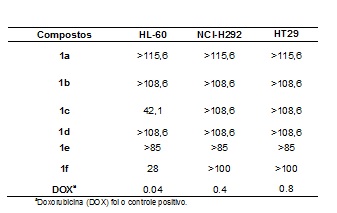
Valores de IC50 em µM para os compostos 1a-f.
CONCLUSÕES: Em resumo, descrevemos a avaliação da atividade citotóxica in vitro de seis 3-(aril)-5-(n-pentil)-1,2,4-oxadiazóis (1a-f). Os compostos 1a-f foram testados contra três linhagens de células humanas, onde apenas os compostos de 1c e 1f exibiram atividade antiproliferativa moderada contra linhas de células cancerosas HL-60 com valores de IC50 de 42,1 a 28 µM, respectivamente.
AGRADECIMENTOS: A FACEPE e CNPQ
REFERÊNCIAS BIBLIOGRÁFICA: 1Clapp, L. B. Advances in Heterocyclic Chemistry, A.R. Katritzky, Ed., Academic Press, New York, 20, 65-116, 1976
2Jochims, J.C. In Comprehensive Heterocyclic Chemistry II; Katritzky, A.R.; Rees, C.W.; Scriven, E.F.D., Eds.; Elsevier Science: Oxford, 1996, 4, 179.
3 Eloy, F.; Lenaers, R. Helv. Chim. Acta 1966, 49, 1430.
4 Harsanyi, K.; P. Kiss, P.; Korbonits, D.; Malyata, I. R. Arzneim. Forsch. 1966, 16, 615.
5 Kumar, D.; Patel, G.; Chavers, A. K.; Chang, K.-H.; Shah, K. Eur. J. Med. Chem. 2011, 46, 3085.
6BERRIDGE, M. V., TAN, A. S., McCOY, K. D., WANG, R. The Biochemical and Cellular Basis of Cell Proliferation Assays that Use Tetrazolium Salts. Biochemica, 4: 14-19, 1996.
7de Freitas, J. J. R.; de Freitas, J. C. R.; da Silva, L. P.; de Freitas Filho, J. R.; Kimura; G. Y. V.; Srivastava, R. M. Tetrahedron Lett. 2007, 48, 6195.
8Vasconcelos, I. B.; da Silva, T. G.; Militao, G. C. G.; Soares, T. A.; Rodrigues, N. M.; Rodrigues, M. O.; da Costa, N. B.; Freire, R. O.; Junior, S. A. RSC Adv. 2012, 2, 9437.
9Buarque, C. D.; Militão, G. C. G.; Lima, D. J. B.; Costa-Lotufo, L. V.; Pessoa, C.; Moraes, M. O.; Cunha-Junior, E. F.; Torres-Santos, E. C.; Netto, C. D.; Costa, P. R. R. Bioorg. Med. Chem. 2011, 19, 6885.
