Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Orgânica
TÍTULO: Desenvolvimento e inserção de novos biocatalisadores suportados em processos sintéticos de obtenção de adutos de Mannich.
AUTORES: Oliveira Nunes, F. (UFGD) ; Ferreira Duarte, B. (UFGD) ; Bastos de Oliveira Filho, E. (UFGD) ; Pompilio Darbem, M. (UFGD) ; Boarin Alcalde, L. (UFGD) ; Batista Dias, K. (UFGD) ; Rufino de Oliveira, A. (UFGD) ; Wellington Rinaldi, A. (UEM) ; Luis de Campos Domingues, N. (UFGD)
RESUMO: Este trabalho visou à obtenção de novos biocatalizadores, feitos a partir da imobilização de variadas enzimas em suporte de quitosana β(1-4)-2-amino-2-deoxi-D-gilcose aplicados na reação de Mannich. O suporte de quitosana foi imerso em solução de glutaraldeído sem agitação, posteriormente filtrado e o sólido agitado em solução enzimática. O catalisador após preparo foi inserido na reação de Mannich que consiste na adição de um aldeído, uma cetona e uma amina. A enzima imobilizada obteve um melhor resultado, tendo em vista o tempo e o rendimento observado. O processo de imobilização é viável, pois reduz o tempo reacional mantendo um rendimento perto do original e possibilitando a reutilização do catalisador.
PALAVRAS CHAVES: Biocatalizadores; Quitosana; Reação de Mannich
INTRODUÇÃO: Biocatálise é uma área que vem sendo muito explorada recentemente, devido à rica atividade catalítica das enzimas. Catalisadores enzimáticos possuem alta seletividade, atividade e especificidade, tornado a biocatálise mais vantajosas que os catalisadores químicos. Um pequeno problema em se utilizar as enzimas como catalisadores é como retira-la do meio reaciona. Isto torna o processo catalítico caro decorrente do valor agregado correspondente às enzimas e tornando o processo em larga escala economicamente inviável. Ao usar enzimas imobilizadas esse tipo de problema praticamente não existe, visto que as mesmas são imobilizadas em suporte sólido praticamente insolúvel, tornando possível a retirada do catalisador do meio reacional, abrindo assim a possibilidade da reutilização do catalisador. A imobilização de enzimas é uma área de grande interesse para a química sintética e para a indústria, pois permite a reutilização do catalisador varias vezes sem perdas significativas de rendimento e tornando a aplicação destes materiais possível em diversos tipos de reação capazes de gerar uma grande gama de compostos enantiomericamente puros. Neste trabalho foi usado a quitosana β(1-4)-2-amino-2-deoxi-D-gilcose como suporte para as imobilizações por ser considerado um excelente suporte para imobilização de enzimas, devido a grande presença de grupos amino e hidroxilas disponíveis em sua estrutura possuem propriedades hidrofílicas, biocompatível, biodegradável, e antibactericida, baixo custo e vem sendo abundantemente empregada em áreas como medicina, agricultura, farmacologia e entre outras (OLIVEIRA; VIERA 2006). Portanto, este trabalho tem por objetivo o desenvolvimento de novos catalisadores enzimáticos suportados em quitosana e a aplicação destes nas reações de Mannich.
MATERIAL E MÉTODOS: Foi realizada a imobilização das enzimas em 1,0 g suporte de quitosana, por meio de imersão da mesma em glutaraldeído por 1 hora, filtragem e o sólido imerso em uma solução enzimática de 0,45g de enzima em 10 ml de água, por 12 horas sobre agitação. Após as 12 horas o catalisador é filtrado, lavado com água destilada e seco por 24 horas. Essa imobilização foi repetida com as seguintes enzimas: quimosina; lipase proveniente do pâncreas do porco; lipase proveniente do rhizopus niveus; albomina bovina; l arabinose e riboflavin. Após a imobilização foi testada a atividade catalítica da enzima imobilizada nas reações de Mannich,através da reação de 4,92 mmol de formaldeído, 4,92 mmol de anilina, 4,92 mmol de ciclohexanona, 0,5 g de catalisador e 17 mL de THF, em agitação magnética utilizando-se o tempo descrito na Tabela 1.
RESULTADOS E DISCUSSÃO: Foi notado que ao se alterar a enzima o rendimento apresentou variações que podem ser atribuído as diferentes composições apresentada pelas enzimas. Mesmo a imobilização pode provocar alterações conformacionais da enzima as quais alteram seus sítios ativos, tornando a mesma mais ou até menos reativa do que antes. A reação realizada com a quimosina não imobilizada forneceu maior rendimento, porém a reação não ocorreu antes do tempo de 48 horas, já a reação com a imobilizada com 5 horas forneceu o produto desejado. As vantagens do uso da enzima imobilizada podem ser confirmadas por alguns dados literários: a) prolongamento da vida útil do catalisador, visto que a enzima não é desnaturada ao termino da reação; b) facilidade da separação do catalisador e do produto da reação, por estar na forma insolúvel ao meio reacional, evitando assim a contaminação do meio reacional; c) evita a ocorrência de reações indesejáveis e a contaminação do meio reacional, pois em alguns casos, as propriedades em relação à sua forma livre são alteradas, como por exemplo, pode aumentar a estabilidade ao pH e à temperatura e facilitar a interrupção do processo reacional, quando chega ao estado desejado pela retirada do catalisador.(CASTRO; ANDERSON,1995). Cumpre informar que novos estudos estão em processo voltados tanto à reutilização do catalisador quanto ao aumento do rendimento do produto desejado e dados promissores estão sendo obtidos. O solvente usado foi escolhido devido à analises dos dados experimentais provenientes da reação feita com a quimosina não imobilizada.(LIMA, 2012).
Tabela 1
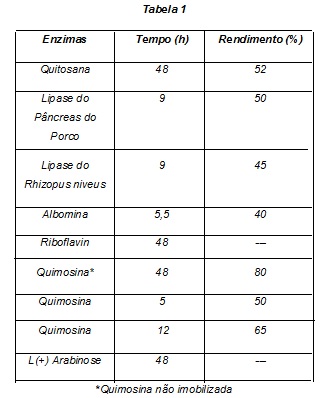
Tabela com rendimentos obtidos ao aplicar à biocatálise a reação de Mannich.
CONCLUSÕES: Com esse trabalho comprovou-se a efetividade do método de imobilização enzimática em quitosana. Já a atividade catalítica pode ser comprovada por meio da reação de Mannich, sendo a quimosina a enzima imobilizada mais viável considerando tempo gasto e o rendimento gerado. Foi constatada a imobilização por meio de analises de Microscopia Eletrônica de Varredura (MEV), Infravermelho com Transformada de Fourier (FT-IR) e analise termo gravimétrica (TGA).
AGRADECIMENTOS: Os autores agradecem ao CNPQ, UFGD, FUNDECT e ao LMH.
REFERÊNCIAS BIBLIOGRÁFICA: DEMIR, S.; GÖK, B. S.; KAHRAMAN, M. V., α-amylase immobilization on functionalized nano CaCO3 by covalent attachment. Starch/Starke 2012, 64, 3. I. R. W. Z. de OLIVEIRA and I. C. VIEIRA ,Construção e aplicação de biossensores usando diferentes procedimentos de imobilização da peroxidase de vegetal em matriz de quitosana. Quim. Nova, 2006, 29, 932. CASTRO, H. F.; ANDERSON, W. A. Fine chemical by biotransformation using lípases. Quimica Nova, v. 18, n. 16, p. 544-554, 1995. LIMA .S .A. C. Síntese de derivados de β-aminocetônicos via reação de Mannich utilizando biocatalizadores. 30 de março de 2012. 82 f. Dissertação (Mestrado em ciência e Tecnologia Ambiental)-UFGD Dourados-Ms 2012.
