Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Orgânica
TÍTULO: Obtenção de ácidos borônicos através de reações de Biginelli
AUTORES: e Silva, N.A.A. (UFF) ; Martins, D.L. (UFF)
RESUMO: Neste trabalho, descreve-se o preparo de dihidropirimidinonas e
dihidropirimidinotionas contendo ácidos borônicos, através de reações de
Biginelli.
PALAVRAS CHAVES: Biginelli; reações multicomponentes; ácidos borônicos
INTRODUÇÃO: A reação de Biginelli é empregada na síntese de dihidropirimidinonas (DHPM).
Trata-se de uma reação multicomponente onde ocorre a condensação de um aldeído
com a ureia (ou tioureia) e um β-cetoester [1]. As reações multicomponentes são
realizadas em um pote único (one-pot) e, portanto, apresentam as seguintes
vantagens: intermediários reacionais não precisam ser isolados, diminuindo o
número de etapas do processo como um todo; economia de solventes; redução de
resíduos e ganho de complexidade molecular em tempos menores [2].
As DHPM apresentam muitas atividades biológicas: anti-inflamatória,
antifúngica, antibacteriana, antiviral, anticancerígenas, anti-hipertensivas
[3a] e bloqueadora de canais de Cálcio [3b]. Deste modo, esta classe é um alvo
sintético interessante.
Neste contexto, podemos destacar as DHPM que contém o grupamento borono; uma vez
que compostos de boro tem encontrado aplicações crescentes na química medicinal.
O bortezomibe é um fármaco em utilização corrente na terapia do mieloma
múltiplo, o qual contém a porção borono. Além disso, ácidos borônicos são
intermediários importantes em síntese orgânica, podendo ser empregados em
reações de acoplamento C-C catalisados por Pd como, por exemplo, em reações de
Suzuki [4].
Neste trabalho, foram preparados diferentes ácidos borônicos contendo a
porção DHPM através de reações de Biginelli, utilizando como aldeídos os ácidos
4-formil e 3-formilfenilborônicos (Esquema 1).
MATERIAL E MÉTODOS: Em um balão de fundo redondo de 25 mL de capacidade, foram adicionados: aldeído,
acetoacetato de etila e ureia (ou tioureia), e o solvente (etanol ou
acetonitrila). Todos os solventes e reagentes foram empregados sem purificação
prévia. Nos casos onde um catalisador foi empregado, adicionou-se ao balão 20% mol
do catalisador.
O sistema foi mantido sob agitação magnética e refluxo e a reação, acompanhada
por cromatografia em camada fina (c.c.f).5 Os produtos obtidos foram
caracterizados por 1H-RMN e espectroscopia na região do IV e seus pontos de fusão
capilares não corrigidos foram determinados.
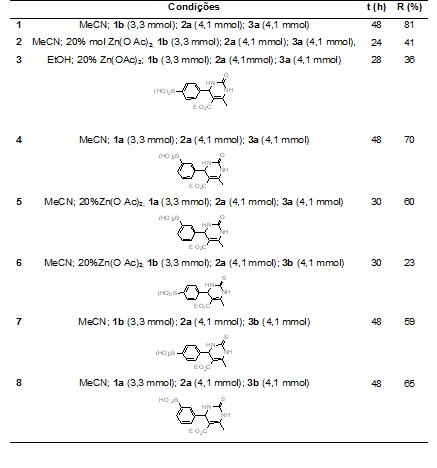
RESULTADOS E DISCUSSÃO: Foram preparadas DHPMs através de reações de Biginelli (Esquema 1, Tabela 1).
As reações de Biginelli com o acetato de zinco como catalisador e acetonitrila
como
solvente, embora tenham sido mais rápidas, necessitaram de purificação
posterior, o que resultou em diminuição significativa do rendimento. Além disso,
nas reações catalisadas, foram obtidos também alguns subprodutos. Comparando o
comportamento da tioureia com a ureia nas reações catalisadas, percebe-se que a
reação é mais rápida com esta última, além de se obter um melhor rendimento.
Através da análise das entradas 2 e 3, pode-se notar que, ao utilizar
acetonitrila como solvente, o rendimento foi melhor do que com etanol. Por esta
razão, este solvente foi escolhido para as demais reações.
Nas reações com tioureia, obteve-se melhor rendimento com o aldeído 3-
formilfenilborônico 1a do que com o aldeído 4-formilfenilborônico 1b (entradas 7
e 8).
Esquema 1- Reação de Biginelli
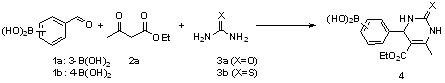
Tabela 1 – Reações de Biginelli com ácidos formilfenilborônicos
CONCLUSÕES: Os ácidos borônicos foram obtidos com sucesso através das reações de Biginelli e
as melhores condições foram: ausência de catalisador em acetonitrila
AGRADECIMENTOS: Os autores agradecem à FAPERJ e à PROPPI-UFF.
REFERÊNCIAS BIBLIOGRÁFICA: [1] a) Batalha, P. N. Rev. Virtual Quim. 2012, 4, 13. b) Duguai D. R.; Vogels M.; Wheaton S.L.; Baerlocher F. J.; Decken A., Westcott S. A. Cent. Eur. J. Chem. 2008, 6, 562.
[2] Martínez, J.; Romero-Veja, S.; Abeja-Cruz, R.; Álvarez-Toledano, C.; Miranda, R. Int. J. Mol. Sci. 2013, 14, 2903-2915.
[3] a) Patil,D. R.; Salunkhe, S. M.; Deshmukh, M. B.; Anbhule, P. V. The Open Catal. J., 2010, 3, 83-86. b) Karamat, A.; Khan, M. A.; Sharif, A. J. Chin. Chem. Soc. 2010, 57, 1099.
[4] Appoh,F. E.; Manning, M. J.; Gullon, T. J. et al Cent. Eur. J. Chem. 2008, 6, 359.
[5] Miyaura, N.; Yanagi, T.; Suzuki, A. Synth. Commum. 1981, 11, 513.
