Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Química Orgânica
TÍTULO: SÍNTESE E ATIVIDADE ANTIMICROBIANA DO DERIVADO TIAZOLIDÍNICO 5-(2-HIDROXI-5-CLOROBENZILIDENO)-TIAZOLIDINA-2,4-DIONA
AUTORES: Silva, P.B.G. (UFPE) ; Egito, M.S.E. (UFPE) ; Sena, K.X.F.R. (UFPE) ; Vicalvi, M.C.V. (UFPE) ; Solidônio, E.G. (UFPE) ; Albuquerque, J.F.C. (UFPE)
RESUMO: A síntese de novos fármacos tem contribuído decisivamente para a evolução da terapêutica, através do uso
de metodologias sintéticas e estudos relação estrutura-atividade. Assim, é possível aumentar a atividade
biológica de um composto e reduzir efeitos adversos. Dessa forma, muitos cientistas estão tentando
desenvolver métodos cada vez mais eficazes para esse fim. Derivados tiazolidínicos se destacam por
possuírem propriedades com amplo espectro de ação em diversos alvos biológicos. Neste contexto, um
derivado tiazolidínico foi sintetizado pela condensação da Tiazolidina-2,4-diona com 2-OH-5-Cl-
benzaldeído. Foram analisados rendimento, tempo reacional e estrutura química. O produto foi enviado
para avaliação da atividade antimicrobiana pelo método convencional de difusão em disco de papel.
PALAVRAS CHAVES: atividade antimicrobiana; tiazolidina-2,4-diona; derivado 5-arilideno
INTRODUÇÃO: O grande progresso da química orgânica a partir do final do século passado, e a necessidade de
alternativas terapêuticas mais eficazes no combate às varias doenças, estimulou a busca por fármacos de
origem sintética, com conseqüente incremento do arsenal terapêutico. A síntese de análogos estruturais de
substâncias bioativas objetiva o aumento da atividade biológica e a diminuição de efeitos colaterais
visando sempre atividade mais precisa. Compostos tiazolidínicos são substâncias heterocíclicas
pentagonais contendo em sua estrutura química heteroátomos de nitrogênio e enxofre (GOUVEIA et al.,
2009). Do ponto de vista farmacológico, as tiazolidinas, de modo geral, possuem propriedades
anestésicas, antimicrobianas, anti-inflamatórias, anticâncer, antifúngicas dentre outras (SOHDA et al.,
1990). Os métodos de estudo e obtenção de novos compostos é um deles. A variação ou modificação
molecular realiza mudanças estruturais na molécula original e cria uma série de derivados análogos
parecidos permitindo avaliar a influência exercida pela modificação de um átomo ou grupo de átomos
sobre a atividade biológica que a droga original apresenta (KOROLKOVAS, 1982). Devido ao crescente
número de casos de infecções hospitalares e a resistência dos agentes infecciosos a medicamentos
existentes no mercado é significante a necessidade de investir na pesquisa de novos compostos
antimicrobianos mais potentes. A síntese de fármacos com amplo espectro de ação antimicrobiana é uma
alternativa importante no combate a resistência adquirida por esses patógenos. Com vistas nas
propriedades antimicrobianas desses compostos, vários derivados estão sendo sintetizados e testados
contra diferentes micro-organismos. Este trabalho teve o objetivo de testar a atividade antimicrobiana do
composto Ju-605.
MATERIAL E MÉTODOS: O composto 5-(2-OH-5-Clorobenzilideno)-tiazolidina-2,4-diona (Ju-605) foi sintetizado partindo da tiazolidina-2,4-diona (Ju-32) 0,200g (0,0017 moles) dissolvida em 5 mL de etanol e adicionado piperidina. A mistura foi mantida sob agitação magnética à temperatura ambiente durante 10 minutos. Em seguida foi adicionado o reagente 2-OH-5-Clorobenzaldeido (0,0017 moles). A reação foi levada ao banho de óleo a 75 ºC e mantida sob agitação magnética (figura 1). Após o período de 68 horas o conteúdo do balão foi vertido para um béquer, resfriado, filtrado e lavado com água, para retirar vestígios da base, e em seguida com hexano para retirar pequenas impurezas e determinar suas constantes físicas. Os testes para a determinação da atividade antimicrobiana foram realizados no Departamento de Antibióticos da UFPE frente aos micro-organismos pertencentes à Coleção de Culturas deste Departamento. Na realização do teste foram utilizados os seguintes micro-organismos: Gram-positivos: Staphylococcus aureus, Bacillus subtilis, Micrococcus luteus, Enterococcus faecalis; bactérias Gram-negativas: Escherichia coli, Pseudomonas aeroginosa e Serratia marcescens; bactérias álcool-ácido resistentes: Mycobacterium smegmatis e Levedura: Candida albicans. Foram utilizados discos de 6 mm de diâmetro. Os discos foram impregnados com uma solução do produto e colocados sobre a superfície do meio Müeller-Hinton-Ágar semeado com os micro-organismos teste. Foi preparada uma solução a 15.000 μg/ml, e os discos foram impregnados com 20 μL da mesma, obtendo a concentração de 300 μg em cada disco e as placas incubadas por 24-48 horas. Os halos de inibição foram mensurados com régua e sua atividade foi evidenciada. O teste foi realizado em triplicata.
RESULTADOS E DISCUSSÃO: As propriedades físico-químicas dos compostos Ju-32 e Ju-605 estão expressas na Tabela 1. As estruturas químicas foram comprovadas por meio de métodos físicos de espectroscopia de Ressonância Magnética de Hidrogênio e de Carbono treze (RMN1H; RMN13C), Infravermelho (IV) e
espectrometria de Massas. Os resultados de RMN1H e IV dos compostos Ju-32 e Ju-605 estão expressas na Tabela 1. O composto Ju-605 foi submetido aos testes de atividade antimicrobiana contra nove micro-organismos diferentes e apresentou atividade relevante frente às cepas de Staphylococcus aureuS (15 mm); Micrococcus luteus (26 mm); Bacillus subtilis (18 mm); Mycobacterium smegmatis (20 mm) e Enterococcus faecalis (20 mm). Dos quatro micro-organismos Gram-positivos testados todos apresentaram atividades satisfatórias frente ao composto sintetizado, porém em relação a espécie Micrococcus luteus foi visualizada melhor ação antimicrobiana por apresentar o maior halo de inibição (26 mm). O representante do grupo álcool-ácido resistente Mycobacterium smegmatis apresentou halo de 20 mm. O grupo dos micro-organismos Gram-negativos Escherichia coli, Pseudomonas aeroginosa e Serratia marcescens, apresentaram halo de inibição menor que 8 mm, assim como a levedura Candida albicans. Halos iguais ou superiores a 10 mm de diâmetro são tidos como
satisfatórios no processo de inibição de crescimento do micro-organismo, evidenciando assim, a
ineficiência do composto para esses germes. Os resultados não foram bons para os micro-organismos
Gram-negativos, entretanto, concentrações mais elevadas podem implicar em efeitos citotóxicos,
inviabilizando futuramente o uso dessas moléculas como antimicrobianos.
Figura 1
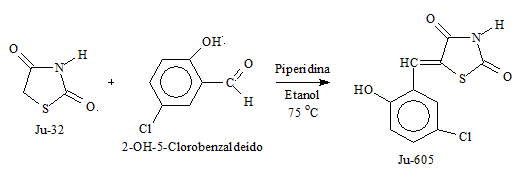
Esquema de síntese do composto Ju-605
Tabela 1
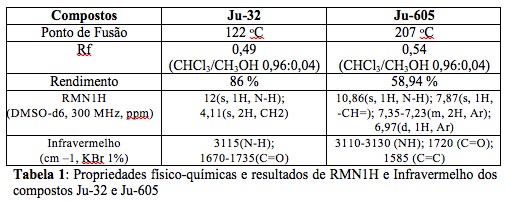
Propriedades físico-químicas e resultados de RMN1H e
Infravermelho dos compostos Ju-32 e Ju-605
CONCLUSÕES: A literatura afirma que o composto inicial tiazolidina-2,4-diona é inativo frente aos microrganismos testados. Mas, quando seu núcleo básico foi substituído na posição 5 do anel heterocíclico, por um grupamento 2-Hidroxi-5-Clorobenzaldeído, o composto obtido (Ju-605) apresentou atividade para cinco dos nove micro-organismos testados. A estrutura química do composto foi comprovada pelos métodos espectrométricos RMN1H, RMN13C, IV e Massas. Os resultados microbiológicos comprovaram que o composto apresenta excelente atividade antimicrobiana, principalmente para os micro-organismos Gram-positivos.
AGRADECIMENTOS: Ao CNPq por financiar a bolsa de mestrado e também a Central Analítica do Depto. de Química Fundamental da UFPE, pelos espectros realizados para o estudo.
REFERÊNCIAS BIBLIOGRÁFICA: GOUVEIA, F. L.; OLIVEIRA, R. M. B.; OLIVEIRA, T. B.; SILVA, I. M.; NASCIMENTO, S. C.; SENA K. X. F. R.; ALBUQUERQUE, J. F. C. 2009. Synthesis, antimicrobial and cytotoxic activities of some 5-arylidene-4-thioxo-thiazolidine-2-ones. European Journal of Medicinal Chemistry, 44: 2047-2053. 2009.
KOROLKOVAS, A. l.; BURCKHALTER, J. H. Química Farmacêutica, Rio de Janeiro, Ed. Guanabara Dois, 1982, 783 p.
SOHDA, T., MOMOSE, Y.,MEGURO, K., KAWAMATSU, Y., SUGIYAMA, IKEDA, H. Studies on ant diabetic agents. synthesis and hypoglycemic activity of 5-[4-(pyridylalkoxy)benzyl]-2,4-thiazolidinediones. Arzneim.-forsch./drug Res., v. 40, n 1, pp. 37-42, 1990.
