Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: Avaliação de metodologias de extração de carotenoides totais em Dunaliella bardawil
AUTORES: Aguiar Brittes Tinoco, N. (UFRJ) ; da Silva Mesquita, S. (UFRJ) ; Ribeiro de Oliveira, M.C. (INT) ; Rodrigues Vianna, S. (UFF) ; Camporese Sérvulo, E.F. (UFRJ) ; Luz Lapa Teixeira, C.M. (INT)
RESUMO: Os carotenoides são pigmentos naturais que podem ser produzidos por determinadas
microalgas e sua extração pode ser realizada por meio do uso de diversos
solventes, sendo a acetona o mais utilizado. Este trabalho objetivou avaliar o
tempo necessário para a máxima extração de carotenoides produzidos pela
microalga Dunaliella bardawil, utilizando solução de acetona 90% e duas
condições operacionais diferentes: extração submetendo ao ultrassom a membrana
com as células da microalga; e extração com a trituração da membrana. Pôde-se
concluir que não houve diferença estatística entre as metodologias e que a
concentração de carotenoides totais não alterou com o aumento do tempo de
extração. Portanto, a metodologia de extração por trituração foi selecionada,
bem como o tempo de 1h de extração.
PALAVRAS CHAVES: Extração; Carotenoides; Dunaliella bardawil
INTRODUÇÃO: O consumo de corantes artificiais pode levar ao desenvolvimento de doenças como
o câncer, urticárias, efeitos genotóxicos, entre outras (GODOY & PRADO, 2003;
AMIN et al., 2010; MPOUNTOUKAS et al., 2010). Com isso, houve um aumento no
interesse de corantes naturais, como os carotenoides, que apresentam coloração
desde o amarelo até vermelho e são encontrados em plantas, algas, bactérias e
fungos (FONTANA et al., 2007).
A microalga Dunaliella bardawil é capaz de acumular até cerca de 10% de seu peso
seco em β-caroteno (BEN-AMOTZ & AVRON, 1990), possuindo uma maior produção
quando comparada a plantas e algas que apresentam cerca de 0,2% de peso seco em
β-caroteno (BEN-AMOTZ et al., 2009).
Diversas metodologias são utilizadas para a extração de pigmentos em
fitoplâncton, como: a extração em solvente (por um determinado tempo), ou a
extração em solvente assistida por ultrassom (WRIGHT & JEFFREY, 2005). O tempo
de contato entre os compostos celulares a serem extraídos e o solvente pode ser
determinante para a quantidade de produtos extraídos. Se a potência da lise
celular ocasionada pelo solvente não for muito elevada, pode ser necessário
recorrer a técnicas de rompimento celular (HENRIQUES, SILVA & ROCHA, 2007).
Segundo Strickland & Parsons (1972) a solução de acetona 90% tem sido utilizada
para extração de pigmentos de fitoplâncton em amostras de água do mar,
apresentando a acurácia adequada na maioria das investigações de estudos de
ecologia marinha.
Este trabalho objetivou avaliar o tempo de extração necessário para se obter o
máximo de carotenoides produzidos pela microalga Dunaliella bardawil, utilizando
como solvente extrator acetona 90% e duas metodologias de extração.
MATERIAL E MÉTODOS: Cultivo da microalga
A microalga Dunaliella bardawil foi cultivada em meio de cultura
descrito por Shaish et al. (1992), contendo NaCl 1,5 M, sob agitação orbital de
180rpm, iluminação contínua de 100µE.m-2.s-1 e temperatura de 25°C±2. Após
alcançar a fase estacionária de crescimento, foram filtrados 10mL de suspensão
celular em membrana de fibra de vidro (GF/P, Sartorius) de poro 0,7µm sob vácuo
de 5mmHg. As membranas contendo as células da microalga foram armazenadas em
nitrogênio líquido, a fim de evitar possíveis mudanças na composição dos
pigmentos até o momento da extração.
Cinética de extração de carotenoides
Nesta etapa foram avaliados diversos tempos para a extração de
carotenoides (1h, 3h, 6h, 9h, 12h e 24h), utilizando duas condições
operacionais, uma reportada por Strickland & Parsons (1972) e outra por Wright &
Jeffrey (1997), visando a máxima extração de carotenoides.
As variações nas condições operacionais de extração foram: submissão da mistura
(membrana cortada e solução de acetona 90%) ao ultrassom após o tempo de
extração; ou trituração (com o bastão de vidro) dos pedaços de membrana cortados
em solução de acetona 90% antes de submeter a mistura ao tempo de extração. As
extrações para cada condição operacional e cada tempo avaliado foram feitas em
triplicata.
Determinação de Carotenoides Totais
A concentração de carotenoides totais extraído foi determinada a partir
da equação abaixo, encontrada no trabalho de Strickland & Parsons (1972):
Carotenoides totais (mg/L) = (7,6.Abs480nm - 3,0.Abs750nm – 1,49.Abs510nm –
2,0.Abs750nm). v/(V.c)
Onde:
v = volume de solução de acetona utilizado na extração (L);
V = volume de suspensão celular filtrada (L);
c = caminho óptico da cubeta que é 1 cm;
Abs = absorvância num dado comprimento de onda em nm.
RESULTADOS E DISCUSSÃO: Na figura 1 e 2, são apresentados os gráficos com os resultados das cinéticas de
extração de carotenoides totais, onde se pode notar que existe uma pequena
variação na concentração dos carotenoides obtidos nos diferentes tempos de
extração, tanto para as membranas submetidas ao tratamento com ultrassom quanto
para as que foram trituradas.
A máxima e a mínima concentração de carotenoides obtida no tratamento de
trituração foi 8,12mg/L em 12 horas e 6,76mg/L em 24 horas de extração,
respectivamente. Já para o tratamento em ultrassom, o máximo e o mínimo extraído
foram, respectivamente, 7,97mg/L em 12 horas e 7,15mg/L em 3 horas. É possível
observar que não há uma tendência no aumento da concentração de carotenoides com
o decorrer do tempo de extração para ambos os tratamentos.
Foi utilizada a análise de variância (ANOVA) com dois fatores e repetições, com
nível de confiança de 95% para a avaliação dos tratamentos utilizados (ultrassom
e trituração) e dos tempos de extração. A partir da análise estatística dos
dados, observou-se que não houve diferença significativa entre as metodologias
(trituração e ultrassonicação), uma vez que o p-valor foi maior que 5%
(p=0,247). Ademais, é possível notar que existe uma diferença entre os tempos de
extração avaliados, pois o p-valor foi menor que 5% (p=6,50x10-5), sendo
provável que essas diferenças estejam associadas aos erros experimentais.
Assim como no presente trabalho, Strickland & Parsons (1972) não observaram
melhora na extração de pigmentos ao submeterem membranas de amostras de água do
mar contendo fitoplâncton ao tratamento com ultrassom. Por outro lado,
Strickland & Parsons (1972) relataram que a extração completa dos pigmentos se
deu num período de 15 a 20 horas, ao contrário do observado em nosso trabalho.
Figura 1
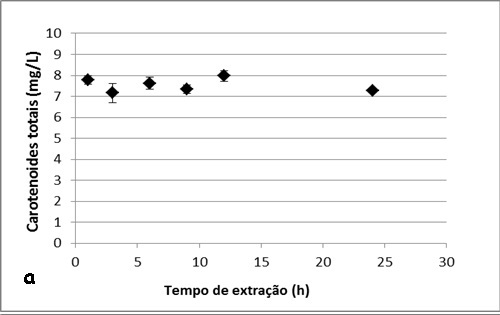
Cinéticas de extração de carotenoides totais utilizando o tratamento com ultrassom.
Figura 2
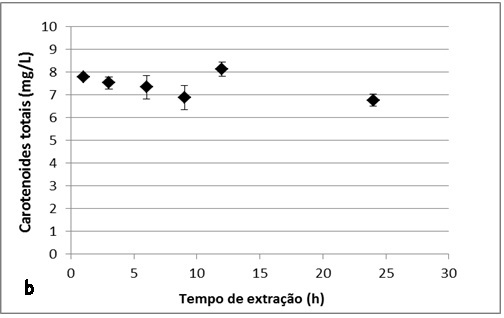
Cinéticas de extração de carotenoides totais utilizando o tratamento por trituração.
CONCLUSÕES: Diante dos resultados apresentados e das pequenas variações de carotenoides totais
extraídos, definiu-se 1h de extração como o tempo suficiente para extrair o máximo
de carotenoides, favorecendo assim, a análise dos extratos imediatamente após a
extração, de maneira a garantir a não isomerização e degradação do β-caroteno. Já
a metodologia escolhida foi a trituração do filtro em lugar do uso da sonda
ultrassônica, a fim reduzir os gastos com energia e simplificar a metodologia.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: AMIN, K. A.; HAMEID, A.; ELSTTAR, A. H. 2010. Effect of food azo dyes tartrazine and carmoisine on biochemical parameters related to renal, hepatic function and oxidative stress biomarkers in young male rats. Food and chemical toxicology, 48: 2994-2999.
BEN-AMOTZ, A.; AVRON, M. 1990. The biotechnology of cultivating the halotolerant alga Dunaliella. Trends in Biotechnology, 8: 121-128.
BEN-AMOTZ, A.; POLLE, J. E. W.; RAO, D. V. S. 2009. The Alga Dunaliella. Enfield. Science publishers, 555.
FONTANA, J. D.; MENDES, S. V.; PERSIKE, D. S.; PERACETTA, L. F.; PASSOS, M. 2007. Carotenóides. Biotecnologia, ciência e desenvolvimento, 13: 40-45.
HENRIQUES, M.; SILVA, A. & ROCHA, J. 2007. Extraction and quantification of pigments from a marine microalga: a simple and reproducible method. Communicating Current Research and Educational Topics and Trends in Applied Microbiology, 586-593.
MPOUNTOUKAS, P.; PANTAZAKI, A.; KOSTARELI, E.; CHRISTODOULOU, P.; KARELI, D.; POLILIOU, S.; MOURELATOS, C. LAMBROPOLOU, V.; LIALIARIS, T. 2010. Cytogenetic evaluation and DNA interection studies of the food colorantes amaranth, erythrosine and tartrazine. Food and Chemical Toxicology, 48: 2934-2944.
PRADO, M. A.; GODOY, H. T. 2003. Corantes artificiais em alimentos. Alimentos e nutrição, 14: 237-250.
SHAISH, A.; BEN-AMOTZ, A.; AVRON, M. 1992. Biosynthesis of β-carotene in Dunaliella. Methods in enzymology, 213: 439-444.
STRICKLAND, J. D. H.; PARSONS, T. R. 1972. A practical handbook of seawater analysis. Pigment analisys. Ottawa: Fisheries Research Bord of Canada, 310.
WRIGHT, S. W. & JEFFREY, S. W. 2005. Pigment Markers for Phytoplankton Production. Handbook of Environmental Chemistry, 2: 1-34.
WRIGTH, S.W. & JEFFREY, S.W. 1997.High resolution HPLC system for clorophylls and carotenoids of marine phytoplankton. In: Phytoplankton pigments in oceanography. Ed. By Jefrey et al., UNESCO
