Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: Avaliação do etanol como agente precipitante de glicosil hidrolases produzidas por Trichoderma harzianum P49P11
AUTORES: Mariño, M. (UNICAMP) ; Miranda, E. (UNICAMP) ; Freitas, S. (CTBE)
RESUMO: O crescente interesse pelo aproveitamento da matéria-prima renovável vem
demandando tecnologias mais eficientes para o desenvolvimento dos processos de
produção de etanol de segunda geração, a fim de reduzir os altos custos
associados com as etapas de produção de enzimas durante a sacarificação. Este
estudo teve como objetivo principal formular as condições necessárias para a
formação de concentrados enzimáticos de glicosil hidrolases por precipitação com
etanol, a fim de reduzir o volume de armazenamento do sobrenadante clarificado
obtido após fermentação de T. harzianum P49P11. Os resultados mostraram que este
método pode ser usado para armazenar xilanase em forma estructuralmente estável
sem desnaturação após o processo de precipitação, inclusive na maior temperatura
testada.
PALAVRAS CHAVES: glicosil hidrolases; Trichoderma harzianum; precipitação de proteínas
INTRODUÇÃO: Uma nova linhagem do fungo Trichoderma harzianum, isolada da Amazônia,
apresentou o mesmo potencial de T.reesei e vantagens do ponto de vista
industrial para hidrolisar fitobiomassa (Delabona et al., 2012). Mesmo assim,
diversos fatores associados às enzimas tendem a limitar a velocidade da
hidrólise, sendo principalmente: inibição e desnaturação durante os longos
períodos de reação e grandes quantidades de substrato necessárias para induzir
as enzimas que envolvem o processo de sacarificação de hemicelulose a nível
industrial (Kadam et al., 2004; Laureano et al., 2005; Palmqvist et al., 1996).
Sabe-se que as moléculas de proteína em um estado precipitado exibem alta
estabilidade por causa da restrição de sua mobilidade, uma vez que é reduzida a
probabilidade de alteração das espécies proteicas ativas de tipo nativo (Schmid,
2011). Em vista disso, a precipitação é considerada como uma técnica simples
para concentrar e armazenar proteínas de modo compacto, estável e pronto para a
aplicação a que se destina (Queiroz et al., 2001). Especificamente, a
precipitação proteica con etanol oferece a vantagem de evaporar e reciclar este
agente precipitante por destilação simples, reduzindo assim o impacto ambiental.
O complexo de hemicelulases varia segundo os polímeros heterogêneos presentes na
biomassa utilizada e envolve principalmente as celulases e xilanases,
constituintes do grupo de hidrosil hidrolases. Deste modo, o potencial do etanol
como agente precipitante de xilanases e celulases pode ser uma técnica adequada
para facilitar seu armazenamento e transporte, a fim de contribuir com a
velocidade de hidrólise do material hemicelulósico através do incremento da
atividade enzimática volumétrica por adição de concentrados enzimáticos.
MATERIAL E MÉTODOS: Xilana de bétula 95588 da Fluka-Sigma (EUA). Todos os outros reagentes foram de
grau analítico.
As enzimas hidrolases foram produzidas por fermentação submersa de T. harzianum
P49P11 em bioreator BioFlo 110 de 20 L (New Brunswick) com bagaço de cana
explodido e desligficado suplementado com sacarose 3:1 (10 g/L) durante 72 horas
com agitação por impelidor (30% de saturação de oxigênio dissolvido) e pH 5,0 a
29°C. A pre-inoculação fez-se com xilose como fonte de carbono (10 g/L)
crescidos em frascos Erlenmeyer (100 mL) e agitação de 100 a 150 rpm por 48
horas. A inoculação foi feita em seguida com 5% (v/v) para 5 L por 96 horas em
BioFlo 310 de 14 L e usando bagaço de cana explodido e deslignificado.
O isolamento do meio extracelular foi realizado centrifugando o extrato bruto a
9000 g (Centrifuge Sorvall RC 6+) durante 20 minutos e posteriormente filtrado
com papel Whatman No.1. O fermentado clarificado foi estocado em volumes de 2 L
a -20°C, sendo descongeladas, retiradas e centrifugadas alíquotas de 15 mL (4800
g por 10 minutos) para os ensaios de precipitação.
A temperatura dos ensaios de precipitação foi mantida usando banhos TE-2000 da
Tecnal (Brasil) e nos ensaios enzimáticos, realizados em placa PCR, foi
utilizado um termociclador Nexus da Epperdorf (Alemanha). O tempo de incubação
dos ensaios de precipitação foi de 6 horas após homogenização por inversão
usando 2 mL como volume final.
A determinação das atividades enzimáticas foi realizada no fermentado
clarificado e nos precipitados após centrifugação a 4800xg por 10 minutos,
separação da fase sobrenadante e redissolver em tampão citrato pH 5,0. Para isso
foi reduzida a escala do método colorimétrico do DNS (Miller, 1959; Mandels,
1976; Adney et al., 1996) com xilana 0,5% e 5mg de papel de filtro Whatman No.1
RESULTADOS E DISCUSSÃO: O aumento de pH do fermentado causou uma diminuição das atividades recuperadas
de celulase possivelmente por desativação irreversível de algum domínio
catalítico para uma o mais das enzimas envolvidas neste complexo.
O efeito hidrofóbico e as contribuições eletrostáticas são os principais fatores
responsáveis pela estabilidade estrutural proteica e no caso
da adição de etanol é intensificada a atração entre cargas opostas entre
moléculas de proteína devido à redução da constante dielétrica do meio e a
deslocamento das moléculas de água das áreas superficiais da proteína, enquanto
as moléculas de etanol tendem a interagir com grupos hidrofóbicos da proteína
(Ioune e Timasheff, 1972).
Em relação ao aumento de pH, viu-se diminuída somente
a atividade das celulases já que o pI das xilanases geralmente é alto,
aproximadamente 9,0, e deste modo suas cargas não foram tão afeitadas quantos
as cargas da celulases o qual comprometeu sua atividade sobre substrato sólido
em valores altos de pH. Deste modo, a recuperação das celulares observou-se
depende altamente de interações eletrostáticas na faixa de pH estudada. Além
disso, as xilanases possuem maior termoestabilidade associada a sua estrutura, o
qual diminui em maior medida sua tendência ao desdobramento principalmente pela
formação de núcleos altamente hidrofóbicos e pela composição de aminoácidos que
estabilizam a estrutura secundária a elevadas temperaturas (Pack e Yoo, 2003).
Mesmo assim, a 25°C as recuperações das atividades de celulase e xilanase nos
precipitados diminuíram pela excessiva solubilidade proteica e/ou por uma
mudança irreversível da conformação proteica nativa.
A precipitação com etanol demostrou ser um método eficaz para recuperar
xilanases produzidas por T. harzianum P49P11.
Recuperação de celulase (FPase) após precipitação com etanol
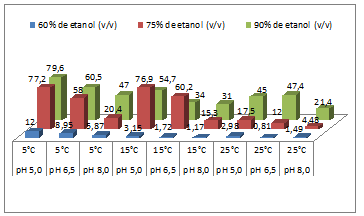
O perfil de precipitação a 5°C conservou-se a 15°C,
sendo maior a recuperação com 75% de etanol e pH 5,0
do fermentado. A 25°C a recuperação diminuiu.
Recuperação de xilanase por precipitação com etanol
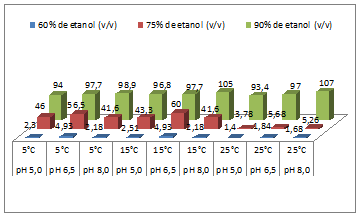
Recuperação completa da atividade xilanásica foi
possível com 90%(v/v) de etanol independente dos
valores de pH do fermentado e temperatura testados.
CONCLUSÕES: A utilização da precipitação do complexo xilanolítico de T. harzianum por
etanol configura-se como um procedimento de pré-purificação eficaz,
possibilitando uma grande economia de reagentes e apresentando-se como uma forma
estruturalmente estável de armazenar e transportar facilmente glicosil
hidrolases, sem risco de desnaturação no caso das xilanases recuperadas com 90%
(v/v) de etanol.
Em termos das mudanças conformacionais, o complexo celulolítico mostrou menor
termoestabilidade em solução alcoólica e maior dependença do pH nas condições de
precipitação testadas.
AGRADECIMENTOS: Agradeço ao Laboratório Nacional de Ciência e Tecnologia do Bioetanol e ao
Conselho Nacional de Desenvolvimento Científico e Tecnológico.
REFERÊNCIAS BIBLIOGRÁFICA: Adney, B., Baker, J. Measurement of cellulose activities. Chemical analysis and testing task laboratory analytical procedure. National Renewable Energy Laboratory (NREL), LAP-006, 1996.
Delabona, P. Farinas, C. Silva, M. Azzoni, S. Pradella. J. C. Use of a new Trichoderma harzianum strain isolated from the Amazon rainforest with pretreated sugar cane bagasse for on-site cellulase -production. Bioresource Technology, 107, p. 517-521, 2012.
Inoue, H., Timasheff, S. N. Preferential and absolute interactions of solvent components with proteins in mixed solvent systems. Biopolymers, 11(4), p. 737–743, 1972.
Kadam, K. L., Rydholm, E.C., Mcmillan, J. D. Development and validation of a kinetic model for enzymatic saccharification of lignocellulosic biomass. Biotechnology, 20, p. 698-705, 2004.
Laureano-Perez, L., Teymouri, F., Alizadeh, H., Dale, B. E. Understanding factors that limit enzymatic hydrolysis of biomass. Applied Biochemistry and Biotechnology, 121/124, p. 1081-1099, 2005.
Mandels, M. Andreotti, R. Roche, C. Measurement of saccharifying cellulose. Biotechnology and Bioengineering Symposiums, p. 21-33, 1976.
Miller, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, (3) 31, p. 426-428. 1959.
Palmqvist, E., Hahn-Hagerdal, B., Galbe, M., Zacchi, G. The effect of water-soluble inhibitors from steam-pretreated sprucewood on enzymatic hydrolysis and ethanol fermentation. Enzyme and Microbial Technology, 19, p. 470-476, 1996.
Queiroz, J. A., Tomaz, C. T., Cabral, J. M. S. Hydrofobic interaction chromatography of proteins. Journal of Biotechnology, 87, p.143-159, 2001.
Schmid, Katja Christine. Spray drying of protein precipitates and Evaluation of the Nano Spray Dryer B-90. Munique: Faculdade de Química e Farmácia, Universidade Ludwig-Maximilians, 2011. p. 3. Tese (Doutorado em Farmácia, Tecnologia Farmacêutica e Biofarmacêutica).
