Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: Imunossensor eletroquímico baseado em anticorpo monoclonal disperso em matriz de polivinil formal e nanopartículas de ouro para a detecção de lipoproteínas de baixa densidade (LDL)
AUTORES: Max Nascimento Egito, E. (UFPE) ; Lima de Oliveira, M.D. (UFPE) ; Palmeira da Costa, M. (UFPE) ; Souza de Andrade, C.A. (UFPE)
RESUMO: O presente trabalho possui como principal objetivo avaliar atividade sensora de
anticorpo monoclonal (anti-LDL), imobilizado em matriz composta por polivinil
formal (PVF) e nanopartículas de ouro (nanoAu), frente a amostras biológicas
obtidas de sangue periférico humano. Os resultados demonstraram que o sistema
PVF_nanoAu fornece uma excelente superfície para adsorção de anticorpo monoclonal
anti-LDL. Após a adsorção, o anticorpo anti-LDL manteve sua atividade biológica
exibindo diversos padrões de reconhecimento frente às amostras de sangue
periférico apresentando um limite de detecção de 10 mg/dl. Portanto, verifica-se
o grande potencial de aplicabilidade do anticorpo Anti-LDL disperso no sistema
PVF_nanoAu para o desenvolvimento de um imunossensor para LDL.
PALAVRAS CHAVES: Impedância eletroquímica; Imunossensor; Anticorpo
INTRODUÇÃO: As lipoproteínas plasmáticas são partículas constituídas por uma parte central
de lipídios hidrofóbicos, circundados por uma monocamada de lipídios polares e
apoproteínas (Siqueira et al, 2006). São sintetizadas e secretadas pelo fígado
(VLDL), intestino (quilomícrons), ou resultam de transformações sofridas por
estas partículas, como é o caso da LDL e HDL (Siqueira et al, 2006). O aumento
da concentração da lipoproteína de baixa densidade (LDL) é um importante fator
de risco para doença arterial coronariana (DAC) (Mykkanen et al, 1999). Além
disso, a DAC é uma das principais causas de mortalidade não somente nos países
desenvolvidos, mas também em alguns países em desenvolvimento (Cheng et al,
2005).Os anticorpos monoclonais têm sido comumente utilizados para mensurar
níveis de colesterol LDL in vivo. A adsorção de anticorpos monoclonais anti-LDL
em diferentes substratos, tem sido largamente estudada no intuito do
desenvolvimento de imunossensores “point of care”, com aplicação em análises
clínicas (Ahmadrajia e Killard, 2013).O presente estudo possui como objetivo
analisar a interação do anticorpo monoclonal anti-LDL imobilizado em filme de
AuNp_PVF, e avaliar sua capacidade de reconhecimento frente a LDL do soro de
pacientes. Atualmente, a aterosclerose é considerada uma doença crônica
degenerativa, que quando não diagnosticado pode acarretar em infarto agudo do
miocárdio. Desta forma, é de grande interesse o desenvolvimento de novas
tecnologias de detecção de LDL, através do uso de ferramentas eletroquímicas,
para a análise de biossensores de análise rápida e sensível (Yan et al., 2008
MATERIAL E MÉTODOS: A análise eletroquímica foi realizada através de um Potencistato/Galvanostato
Autolab 128N. As medidas voltamétricas (VC) e de espectroscopia de impedância
eletroquímica (EIE) foram realizadas numa célula eletroquímica convencional de
três eletrodos imersos em 20 mL de solução de ferro-ferricianeto de potássio,
K4[Fe (CN)6] / K3[Fe(CN)6] (1:1), a 10 mM, atuando como sonda redox. O eletrodo
de trabalho utilizado foi o eletrodo de ouro modificado, o eletrodo de
referência foi o de Ag∕AgCl saturado com KCl e o contra-eletrodo foi o de
platina. As análises de VC foram realizadas em diferentes etapas de construção
do biossensor, a um potencial de varredura fixo de -0,2 a 0,7 V, a temperatura
ambiente. Os espectros da EIE foram obtidos numa faixa de freqüência entre 100
mHz a 100 KHz com um potencial de amplitude alternada de 10 mV. Foram realizadas
análises eletroquímicas do polivinil formal (PVF) a 0,1% em função do tempo de
dispersão (5, 10, 15, 20 e 25 minutos). A seguir 150 uL das nanoAu foram
diluídas em clorofórmio (60%) e etanol (40%). Posteriormente, foi realizada uma
mistura de 1mL de PVF (0,1%) com 150uL da nanoAu. O sistema PVF_nanoAu foi
adosrvido sobre a superfície do eletrodo de ouro por incubação por 10 minutos.
Em seguida, foi adicionado 1uL do anticorpo anti-LDL sobre a superfície do
eletrodo modificado com o sistema PVF_nanoAu por 10 minutos. Posteriormente, o
sistema PVF_nanoAu_Anti-LDL, foi exposto a amostras de sangue periférico humano
com diferentes concentrações do colesterol LDL (10, 40, 70, 100 e 130 mg/mL).
Após cada etapa de modificação do eletrodo, foram realizadas análises de VC e
EIE, respectivamente.
RESULTADOS E DISCUSSÃO: A Fig. 1 demonstra o perfil de adsorção do sistema PVF_nanoAu em diferentes
tempos de incubação. Os dados de voltametria cíclica revelou um comportamento
característico limitado por difusão do eletrodo de Au limpo e de bloqueio de
superfície na presença de PVF_nanoAu.As análises de EIE (Fig. 2) mostram que
após a modificação do eletrodo com o sistema PVF_nanoAu e PVF_nanoAu_antiLDL,
houve aumento da impedância total do sistema. Após a interação do sistema
antiLDL com os soros de LDL (10-130 mg/dl) foi observado um bloqueio quase que
total da superfície à passagem de elétrons na concentração de 130 mg/dl, o que
denota biointeração entre anticorpo-antígeno.O gráfico de Nyquist mostra o
aumento gradativo da resistência de transferência de carga após o processo de
biointerção. A resposta impedimétrica do sistema PVF_nanoAu_antiLDL apresentou
um de RTC=3,4 kΩ e após a interação anticorpo-antígeno houve um incremento da
resposta impedanciométrica, revelando um de RTC=9,8 kΩ para a concentração de
130 mg/dl. Os resultados obtidos neste trabalho reflete a possibilidade de
detecção de colesterol LDL por meio das técnicas eletroquímica VC e EIE. Outros
autores mostram a viabilidade do uso da espectroscopia de ressonância de
plásmons para análise de LDL (Snellings et al., 2004). Desta forma, podemos
observar a possibilidade de detecção eletroquímica de LDL baseado em matriz de
polivinilformal e nanopartículas de ouro para análise de níveis sanguíneos em
pacientes com hipercolesterolemia.
Voltograma Ciclico
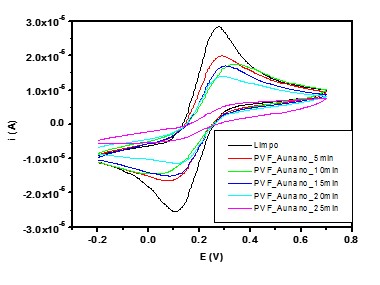
Figura 1. Análise de voltametria cíclica em função
do tempo do sistema contendo PVF e nanopartículas de
ouro (nanoAu).
Impedancia Eletroquimica
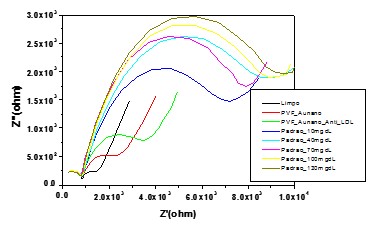
Figura 2. Análise impedimétrica do sistema
PVF_nanoAu_anti-LDL frente às amostras sanguíneas
contendo distintas concentrações do colesterol LDL
(10, 40, 70, 100 e 130 mg/dL).
CONCLUSÕES: As análises eletroquímicas revelam a influência do tempo sobre o período de
incubação do eletrodo ao sistema PVF_nanoAu. O anticorpo anti-LDL demonstrou ser
suficiente para o processo de biodetecção de lipoproteínas de baixa densidade
(LDL) contidas nas amostras de soro humano. O sistema PVF_nanoAu_Anti-LDL,
conseguiu detectar níveis muito baixo de LDL (10mg/dL) apresentando, demonstrando
uma boa sensibilidade. Portanto, biosistema baseado em anticorpo anti-LDL
apresenta grande potencial para uso em análises clínicas.
AGRADECIMENTOS: FACEPE, CNPq e Rede Nanobiotecnologia-CAPES
REFERÊNCIAS BIBLIOGRÁFICA: MYKKANEN, J. K.; HAFFNER, S. M .; LAAKSO, M.; AUSTIN, M. A. 1999. LDL size and risk of coronary heart disease in elderly men and women, Arteriosclerosis, Thrombosis, and Vascular Biology, 19: 2742-2748.
CHENG, O. 2005. Genetic variation of low-density lipoprotein-cholesterol and its clinical implications. Chinese Medical Journal, 118:355–359.
AHMADRAJIA, T., KILLARD, A. J. 2013. The evolution of selective analyses of HDL and LDL cholesterol in clinical and point of care testing. Anal. Methods, 5:3612-3625
YAN, W., CHEN, X., LI, X., FENG, X., ZHU, J. J. 2008. Fabrication of a label-free electrochemical immunosensor of low-density lipoprotein. J. Phys. Chem. B. 112:1275-1281.
SIQUEIRA, A. F. A.; ABDALLA, D. S. P.; FERREIRA, S. R. G. 2006. LDL: da Síndrome Metabólica à Instabilização da Placa Aterosclerótica. Arquivos Brasileiro de Endocrinologia e Metabologia, 50:334-343.
SNELLINGS, S., FULLER, J., PITNER, M., PAUL, D.W. 2004. An acoustic wave biosensor for human low-density lipoprotein particles: construction of selective coatings. Biosensors and Bioelectronics, 19:353-363.
