Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Bioquímica e Biotecnologia
TÍTULO: Caracterização cinética de lipase em extrato de folha de planta do Cerrado
AUTORES: Ferreira, J.R. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Faleiro, D.S. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Caramori, S.S. (UNIVERSIDADE ESTADUAL DE GOIÁS)
RESUMO: Dentre as diversas enzimas industriais mundialmente comercializadas, destacam-se as lipases (EC 3.1.1.3), devido a sua ampla área de aplicação. Neste trabalho foram estudados os parâmetros cinéticos, como tempo de reação, temperatura e pH ótimo e termoestabilidade, de uma lipase isolada da folha do cajuzinho-do-Cerrado (Anacardium humile St. Hil.). Os resultados encontrados demonstraram que a reação melhor se processava em 5 min em tampão Tris-HCl de pH 9,0 a 60 °C. A atividade da lipase no extrato da folha manteve-se estável até 15 min sob a temperatura de 75 °C, quando apresentou 70,31% de atividade residual. A tolerância ao aumento da temperatura parece estar relacionada a mecanismos de adaptação da espécie vegetal ao clima do Cerrado.
PALAVRAS CHAVES: cajuzinho-do-cerrado; parâmetros cinéticos; termoestabilidade
INTRODUÇÃO: O Cerrado é considerado um dos maiores biomas do território brasileiro (YOKOYAMA et al., 1988), o segundo em riqueza de espécies. Dentre as plantas existentes neste bioma temos Anacardium humile St. Hil., conhecida como cajuzinho-do-cerrado ou cajuí (LONDE, 2005).
A. humile é uma fruteira nativa do cerrado, pertencente à família Anarcadiaceae. Apresenta estruturas subterrâneas como o caule, que para resistir às secas prolongadas tem a capacidade de armazenar água (ALMEIDA et al., 1998).
As lipases são mais comumente estudadas em micro-organismos, devido à facilidade de manipulação das culturas em laboratório e a possibilidade de controle da produção. Entretanto, as plantas são fontes promissoras de enzimas, de onde podem ser extraídas e aplicadas nas mais diversas áreas do conhecimento, sendo ainda acessíveis e apresentando baixo custo de produção (ALVES et al., 2002; PAQUES et al., 2006).
Os processos que utilizam lipases são especialmente atraentes em função das diferentes aplicações desta enzima. As lipases podem catalisar reações de hidrólise, esterificação e interesterificação, com extrema simplicidade de processo, qualidade superior do produto final e excelente rendimento. Estas características conferem às lipases um potencial biotecnológico comparável ao das proteases e carboidrases, estimulando pesquisas para melhora da sua produção, caracterização, imobilização e aplicação industrial (YAHYA et al,. 1998; DE CASTRO et al., 2004).
As enzimas devido a sua natureza proteica são altamente sensíveis a variações de temperatura, pH, concentração da própria enzima, entre outros fatores, portanto, o conhecimento dos melhores parâmetros sobre a reação enzimática de determinada enzima permite explorar melhor as suas propriedades catalíticas (GOMES, 2006).
MATERIAL E MÉTODOS: A medida da atividade enzimática foi testada sob diferentes condições a fim de se melhorar a cinética da reação. Foram adotados para a extração da folha tampão fosfato (0,1mol/L) pH 8,0 e o tempo de extração de 30 min, de acordo com testes laboratoriais realizados previamente. Esta análise foi constituída de três etapas, o resultado de cada etapa foi necessário para a realização da próxima.
O efeito do tempo de incubação sobre a extração da lipase foi realizado nos tempos de 1 a 60 min a 37 °C em tampão Tris-HCl pH 8,0. Em seguida foi testado o efeito do pH sobre a reação da lipase utilizando-se tampão Tris-HCl (0,05mol/L) de em pH 7,2 a 9,0. A temperatura de reação foi testada após a determinação do pH ótimo de reação incubando-se as amostras do ensaio de 30 a 75 °C.
A estabilidade térmica do extrato da folha foi avaliada com incubação da amostra a 75 °C em intervalos de tempo de 5 a 20 min. Em seguida foi retirada uma alíquota de 0,1 mL a cada intervalo de tempo, e após o seu resfriamento, a atividade de lipase residual em cada alíquota foi mensurada nas condições ótimas determinadas para a reação da enzima.
RESULTADOS E DISCUSSÃO: Os parâmetros tempo de reação, pH e temperatura de reação foram avaliados e estão apresentados na Figura 1.
Na Figura 1A observa-se que ocorre um aumento na atividade enzimática até o tempo de 5 min. Esta condição é a mesma adotada para os ensaios-padrão de lipase (WINKLER & STUCKMAN, 1979). Após o tempo de 5 min observa-se que há uma queda na atividade, provavelmente devido à presença de proteases, uma vez que a amostra testada se tratava de extrato bruto.
A curva obtida após a variação no pH de reação mostrou um pico em pH 9,0 (Figura 1B). A temperatura ótima de reação da lipase está entre 60 a 70 °C, pois nesta faixa a atividade manteve-se quase inalterada (Figura 1C). A. humile está distribuída em áreas de Cerrado sensu estrito, um tipo de fitofisionomia com cobertura vegetal predominantemente rasteira. Esta constante exposição ao sol requer que a planta contenha um arsenal bioquímico resistente às altas temperaturas (muitas vezes acima de 40 °C).
As lipases de plantas geralmente apresentam temperaturas ótimas variando de 30 a 40 °C, como as lipases de Cucumeropsis edulis, com temperatura ótima a 37 °C (OPUTE, 1975), Cajanus cajan L. a 30 °C (KHAN et al., 1991; DAHOT et al., 1989.), Carissa carandas a 30° C (MALA & UMAR DAHOT, 1995) e Cocos nucifera L. de 30 a 40 °C (EJEDEGBA et al., 2007).
Na Figura 2 observa-se os resultados obtidos na determinação da termoestabilidade da lipase a 75 °C.
Nos primeiros 10 min de incubação os extratos apresentaram uma queda de 23 % e depois mantiveram-se estáveis até 15 min de exposição a 75 °C. Este comportamento foi similar ao relatado por Pahoja (2012) com Pennisetum glaucum, uma espécie forrageira. A partir de 20 min há uma tendência para uma queda constante na atividade enzimática.
Figura 1
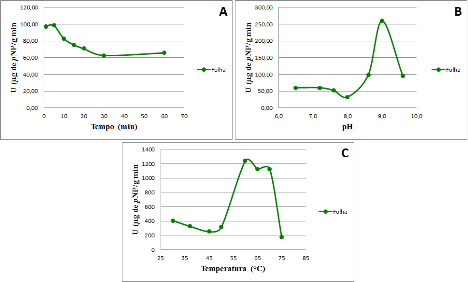
Figura 1- Parâmetros cinéticos do extrato da lipase da folha do cajuzinho-do-cerrado. A: tempo de reação; B: pH de reação; C: temperatura de reação.
Figura 2
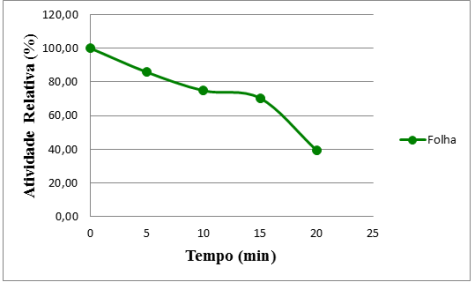
Figura 2- Termoestabilidade da lipase da folha do cajuzinho-do-cerrado.
CONCLUSÕES: Os resultados mostram que a condição ótima de reação da lipase da folha de A. humile ocorre em pH básico. Sua faixa de temperatura ótima esta entre 60 a 70°C, sendo uma faixa de tolerância térmica bastante promissora para futuros estudos, como uma fonte alternativa de lipase para aplicações biotecnológicas, apresentando uma termoestabilidade de até 15 min sob uma temperatura de 75°C.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ALMEIDA, S. P.; PROENÇA, C. E. B.; SANO, S. M.; RIBEIRO, J. F. Cerrado: espécies vegetais úteis. Planaltina: EMBRAPA-CPAC,1998.178p.
ALVES, Maria Helena et al. Screening of Mucor spp. for the production of amylase, lipase, polygalacturonase and protease. Brazilian Journal of Microbiology, v. 33, n. 4, p. 325-330, 2002.
DAHOT, M. U.; KHAN, M. Y.; NOOMRIO, M. H. Isolation and characterization of Cajanus cajan L. seed lipase. In: Proc. National Chem. Conf. 1989. p. 364-375.
DE CASTRO, Heizir F. et al. Modificação de óleos e gorduras por biotransformação. Química Nova, v. 27, n. 1, p. 146-156, 2004.
EJEDEGBA, B. O.; ONYENEKE, E. C.; OVIASOGIE, P. O. Characteristics of lipase isolated from coconut (Cocos nucifera linn) seed under different nutrient treatments. African Journal of Biotechnology, v. 6, n. 6, 2007.
GOMES, Fabrício M. et al. Determinação das propriedades caralíticas em meio aquoso e orgânico da lipase Candida rugosa. Química Nova, v. 29, n. 4, p. 710-718, 2006.
KHAN, M. Y.; DAHOT, M. U.; NOOMRIO, M. H. Investigation of lipase activity from Cajanus cajan L. seed. Pak. J. Sci. Ind. Res, v. 34, p. 384-386, 1991.
LONDE, L. N. 2005. Indução de respostas morfogenéticas em [i]Anacardium humile[/i] St. Hill. (Anacardiaceae) e análise da divergência genética entre populações. Dissertação de Mestrado, Instituto de Genética e Bioquímica, Universidade Federal de Uberlândia, Uberlândia, p. 140, 2005.
MALA, V.; UMAR DAHOT, M. Lipase activity of Carissa carandas fruit. SCIENCE INTERNATIONAL-LAHORE-, v. 7, p. 161-164, 1995.
OPUTE, FRED IDIEM. Lipase activity in germinating seedlings of Cucumeropsis edulis. Journal of Experimental Botany, v. 26, n. 3, p. 379-386, 1975.
PAHOJA, Vajanti Mala. Properties of lipase from Pearl millet seedling. Pakistan Journal of Biochemistry and Molecular Biology (PJBMB), v. 45, n. 1, 2012.
PAQUES, Fernanda Wiermann; MACEDO, Gabriela Alves. Lipases de látex vegetais: propriedades e aplicações industriais. Química nova, v. 29, n. 1, p. 93, 2006.
WINKLER, ULRICH K.; STUCKMANN, Martina. Glycogen, hyaluronate, and some other polysaccharides greatly enhance the formation of exolipase by Serratia marcescens. Journal of Bacteriology, v. 138, n. 3, p. 663-670, 1979.
YAHYA, Ahmad RM; ANDERSON, William A.; MOO-YOUNG, Murray. Ester synthesis in lipase-catalyzed reactions. Enzyme and Microbial Technology, v. 23, n. 7, p. 438-450, 1998.
YOKOYAMA, L. P.; KLUTHCOUSKI, J.; OLIVEIRA, I. P. Impactos socioeconômicos da tecnologia “Sistema Barreirão”. Santo Antônio de Goiás: EMBRAPA-CNPAF, 1998. 37p. [EMBRAPA-CNPAF-BOLETIM DE PESQUISA].
