Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Materiais
TÍTULO: CORROSÃO DE AÇOS INOXIDÁVEIS EM MEIO CONTENDO ÍONS CLORETOS
AUTORES: Moreira, R.R. (UFES) ; Soares, T.F. (UFES) ; Ribeiro, J. (UFES)
RESUMO: O presente trabalho trata-se do estudo do processo de corrosão em dois tipos
distintos de aços inoxidáveis, ferrítico AISI 405 e austenítico AISI 302B, em meio
de solução de cloreto 0,5 mol L-1, com o intuito de verificar o comportamento
desses aços à corrosão. O ensaio eletroquímico foi realizado a partir de medidas
de ruído eletroquímico e curva de polarização. Os resultados obtidos mostraram que
a amostra do aço ferrítico apresentou a formação de um filme passivo na
superfície, responsável pela proteção à corrosão e regiões suscetíveis à corrosão
por pite, porém a amostra do aço austenítico mostrou-se mais suscetível à
corrosão, pois apresentou um potencial de corrosão (Ec) mais negativo do que o aço
ferrítico e ausência de regiões passivas na curva de polarização.
PALAVRAS CHAVES: CORROSÃO; AÇO INOXIDÁVEL; CURVA DE POLARIZAÇÃO
INTRODUÇÃO: A corrosão quanto um fenômeno destrutivo provoca um alto custo à economia e à
sociedade. Os custos estimados podem ser considerados tão altos quanto 5% do PIB
em vários países desenvolvidos (ALMEIDA, 2005; GROYSMAN; BRODSKY, 2006). Seus
efeitos indesejados podem representar: falhas em questão de segurança, causando
desastres e perdas de vidas humanas, interrupção de comunicações, degradação de
monumentos históricos e poluição ambiental (GENTIL, 2011). Geralmente, na
corrosão em água do mar existem dois processos que competem simultaneamente, a
formação do filme passivo em materiais metálicos, devido à presença do oxigênio
dissolvido responsável pela formação de uma fina camada de óxido do metal e a
desintegração desse filme devido à ação do íon cloreto (SHIFLER, 2005; MARTINI;
MULLER, 2000). Um dos aços utilizados em diversos campos devido à alta
resistência à corrosão é o aço inoxidável (CARBÓ, 2001). Esses tipos de aços são
ligas de ferro e cromo com o mínimo de 10,50% de cromo. Porém, apesar de sua
alta resistência, esse tipo de aço pode oxidar, ocasionando a corrosão do tipo
pite, quando em contato com sais presentes na água do mar promovendo a
modificação de sua aparência e estrutura (TSUTSUMI et al., 2007). Os efeitos
gerados pela corrosão são freqüentes e ocorrem nas mais variadas atividades,
sejam elas na indústria química, petroquímica, naval, na construção civil,
automobilística, nos meios de comunicação e em monumentos artísticos (GENTIL,
2011). Diante da necessidade de evitar ou diminuir esses efeitos indesejados
gerados pela corrosão o presente trabalho objetivou estudar o processo de
corrosão em aço inoxidável em meio de solução de cloreto, o qual foi realizado a
partir de medidas eletroquímicas, tais como ruído eletroquímico e curva de
polarização.
MATERIAL E MÉTODOS: Os corpos de provas utilizados para o ensaio eletroquímico foram de duas
amostras de aço inoxidável, aço inoxidável ferrítico AISI 405 e aço inoxidável
austenítico AISI 302B. Antes das medidas eletroquímicas cada corpo de prova foi
submetido a um tratamento de limpeza da superfície, o qual consistiu de um
polimento usando diversas lixas d’água de diferentes granulometrias 220, 320,
400, 600 e 1200 mesch.
As medidas eletroquímicas de potencial de circuito aberto (Eo), com medidas de
ruído eletroquímico, e as curvas de polarização foram executadas em um
Potenciostato/galvanostato da AUTOLAB PGSTAT modelo 302N, em temperatura
ambiente, utilizando uma célula eletroquímica, com três eletrodos, de 100 mL de
capacidade. O eletrodo de referência utilizado foi o eletrodo de Ag/AgCl(KCl
sat.), o eletrodo auxiliar de grafite e o eletrodo de trabalho feito em aço
inoxidável. Os ensaios eletroquímicos foram realizados em meio de solução de
cloreto na concentração de 0,5 mol L-1. Para as medidas de curvas de
polarização, ou seja, curvas de Tafel, variou-se o potencial em ± 200 mV a
partir de Eo, a uma taxa de 0,5 mV/s.
Foi realizado ainda, uma caracterização das amostras de aços inoxidáveis por
meio de medidas de difração de raios X usando um difratometro da BRUKER modelo
D8 DISCOVER com radiação Cu Kα (1,5418 Å), variando o ângulo de difração (2θ)
entre 20 e 100.
RESULTADOS E DISCUSSÃO: As curvas típicas de polarização obtidas para os aços inoxidáveis em meio de
cloreto 0,5 mol L-1 são apresentadas nas Figuras 1 e 2. Pela análise das curvas
observam-se semelhanças nos trechos anódicos, onde a densidade de corrente
cresce com o aumento do potencial, mostrando um comportamento ativo dos metais.
Além disso, é possível verificar que o potencial de corrosão (Ec) do aço
austenítico é mais negativo que do aço ferrítico, o que significa que o processo
de corrosão foi mais facilitado para o aço austenítico.Porém, na curva do aço
ferrítico, é possível observar regiões passivas, onde observa-se a diminuição da
densidade de corrente com o aumento do potencial, o que não ocorre no aço
austenítico. Verifica-se, no entanto, a ocorrência de oscilações da densidade de
corrente nessas regiões da curva de polarização, que caracterizam a existência
de pites instáveis, os quais crescem e repassivam repetidas vezes (RAMÍREZ,
2011). Esse comportamento pode está relacionado ao mecanismo contínuo de
dissolução do aço (Fe(s) → Fe2+(aq.) + 2 e-) que na presença do cloreto reage
formando o cloreto ferroso (Fe2+(aq.) + 2 Cl-(aq.) → FeCl2), que é hidrolisado
formando hidróxido ferroso e ácido clorídrico (FeCl2 + 2 H2O → Fe(OH)2 + 2 HCl),
responsável por diminuir o pH do meio favorecendo e acelerando o processo de
corrosão conforme observado em outras publicações (BRASIL, 2003).Os padrões de
difração de raios X obtidos para as amostras de aços inoxidáveis foram
comparados com o PDF de referência (PDF: 89-7245 e PDF: 00-035-1375,
respectivamente), isso possibilitou a identificação das fases cristalográficas
da estrutura cúbica do Fe-Cr-C para a amostra de aço inoxidável ferrítico e Fe-
Cr-Ni para amostra de aço inoxidável austenítico, também estrutura cúbica.
Figura 1.
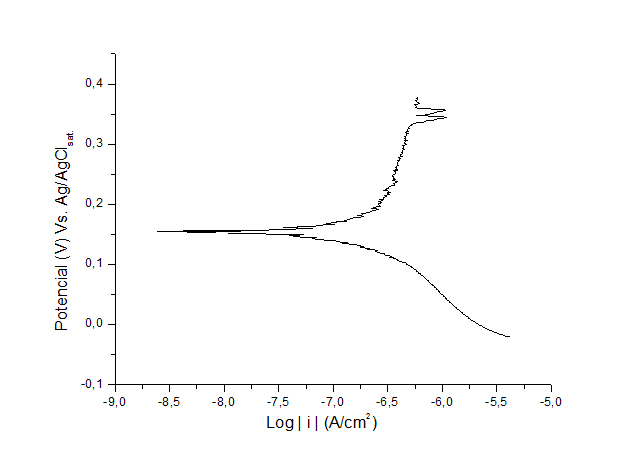
Curva de Polarização do aço inoxidável ferrítico
AISI 405.
Figura 2.
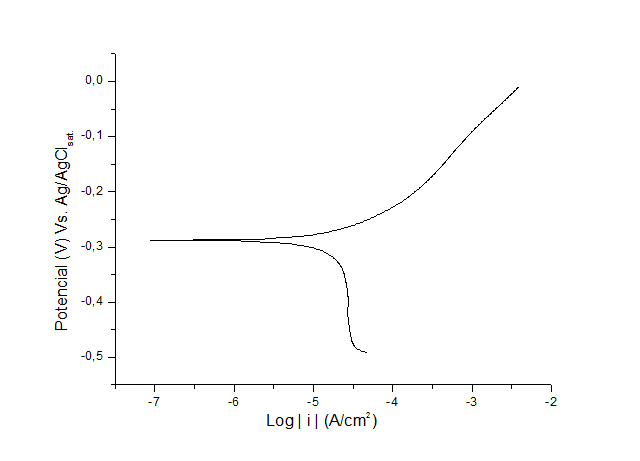
Curva de Polarização do aço inoxidável austenítico
AISI 302B.
CONCLUSÕES: Os resultados obtidos mostraram a maior suscetibilidade do aço inoxidável
austenítico à corrosão em meio de cloreto, uma vez que o Ec foi mais negativo,
sendo observada ainda a ausência de passivação para o mesmo aço. No entanto, para
o aço inoxidável ferrítico foi verificado a formação de filme passivo, responsável
pela proteção à corrosão, porém, com ocorrência de pites instáveis, devido à
contínua dissolução do aço ocasionado pelo íon cloreto presente em solução.
AGRADECIMENTOS: Os autores agradecem a FAPES, CAPES, CNPq, UFES e PETROBRAS.
REFERÊNCIAS BIBLIOGRÁFICA: ALMEIDA, M. 2005. Minimisation of steel atmospheric corrosion: Updated structure of intervention. Progress in Organic Coatings, 54: 81–90.
BRASIL, F. 2003. Estudo de corrosão sob tensão em tubos de aço inoxidável AISI 304 l, aspergidos termicamente com alumínio por arco elétrico. Dissertação (Mestrado). Universidade Federal do Paraná. Curitiba.
CARBÓ, H. M. 2001. Aço Inoxidável Aplicações e Especificação. Núcleo Inox, Acesita.
GENTIL, V. 2011. Corrosão. 6. ed. Rio de Janeiro: Livros Técnicos e Científicos.
GROYSMAN, A.; BRODSKY, N. 2006. Corrosion and Quality, Accred Qual Assur. 10: 537–542.
MARTINI, E. M. A.; MULLER, I. L. 2000. Characterization of the film formed on iron in borate solution by electrochemical impedance spectroscopy. Corrosion Science, 42: 443-454.
RAMÍREZ, A. H. 2011. Influência dos íons brometo e cloreto sobre a resistência à corrosão por pite de diferentes aços inoxidáveis austeníticos e ferríticos. Dissertação (Mestrado). Universidade de São Paulo. São Paulo.
SHIFLER, David A. 2005. Understanding material interactions in marine environments to promote extended structural life. Corrosion Science, 47: 2335–2352.
TSUTSUMI, Y.; NISHIKATA, A.; TSURU, T. 2007. Pitting corrosion mechanism of Type 304 stainless steel under a droplet of chloride solutions. Corrosion Science, 49: 1394-1407.
