Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Iniciação Científica
TÍTULO: LIGAÇÕES DE HIDROGÊNIO ENTRE RCOCH3 (R= -C6H5,-C6H4Me E -C6H4OMe) E HX (X= -F E -CN): UM ESTUDO AB INITIO
AUTORES: Sérgio Silva Oliveira, M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Karine da Luz Belarmino, M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Handrezy Silvério da Silva, H. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Patrícia Vieira, T. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Xavier do Nascimento, R. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Bezerra de Lima, N. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
RESUMO: Neste trabalho nós utilizamos cálculos de orbitais ab initio moleculares para
simular as propriedades estruturais e energéticas de complexos envolvendo
diferentes cetonas, RCOCH3 (R=-C6H5,-C6H4Me e -C6H4OMe), e os ácidos HX, (X= -F e
–CN). Nós empregamos cálculos de orbitais moleculares com o método MP2 e teoria do
funcional de densidade (DFT) com o funcional B3LYP, adicionado ao conjunto de
funções de base 6-31++G(d,p). Os resultados mostraram que seis complexos estáveis
energeticamente podem ser formados entre as cetonas e os ácidos lineares
monopróticos, e o processo de formação das ligações de hidrogênio ocasionaram
mudanças nas propriedades estruturais tanto das cetonas quanto dos ácidos HX.
PALAVRAS CHAVES: ab initio; ligação de hidrogênio; ácidos lineares
INTRODUÇÃO: As ligações de hidrogênio podem ser definidas como: “a ligação formada entre um
grupo doador de prótons e um grupo aceptor de prótons contendo um par de
elétrons isolados”[1]. Esta definição é amplamente aceita em várias áreas da
ciência, como por exemplo, em química, física e biologia. É importante ressaltar
que a formação da ligação de hidrogênio normalmente ocasiona modificações
importantes em várias propriedades moleculares, como, por exemplo, nas
propriedades estruturais das moléculas após a complexação, sendo estas mudanças
mais fortes nos grupos diretamente envolvidos nela[2-3].
As cetonas cíclicas RCOCH3, (R=-C6H5,-C6H4Me e -C6H4OMe), podem ser consideradas
como potenciais aceptoras de próton ácido, uma vez que possuem um grupo C=O, o
qual pode doar densidade de carga eletrônica para o orbital LUMO de ácidos
fracos. Neste trabalho mostraremos as geometrias otimizadas de complexos entre
RCOCH3, (R=-C6H5,-C6H4Me e -C6H4OMe), e HX, (X=-F e –CN), bem como as mudanças
nas propriedades estruturais e as estabilidades energéticas devido a formação
das ligações de hidrogênio nos complexos.
MATERIAL E MÉTODOS: Foram utilizados cálculos ab initio de orbitais moleculares com o método MP2
(Møller-Plesset perturbation theory at second-order) [4] e teoria do funcional de
densidade (DFT)[5] com o funcional B3LYP[6], adicionado ao conjunto de funções de
base 6-31++G(d,p). Para isto, utilizamos o programa de química quântica
computacional GAUSSIAN 03.
RESULTADOS E DISCUSSÃO: A primeira etapa do cálculo computacional empregada foi a de otimização completa
das geometrias de todos os complexos, ou seja, as geometrias mais estáveis
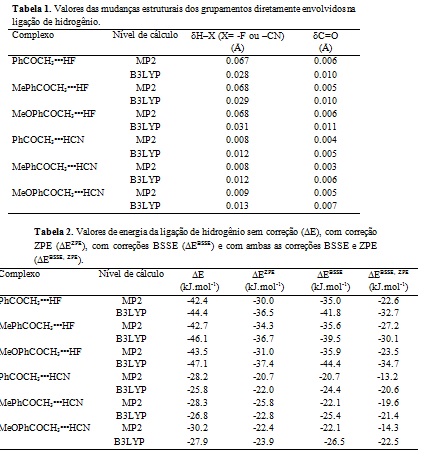
energeticamente. A Fig. 1 apresenta todas as geometrias calculadas. Os cálculos
mostraram que os complexos envolvendo RCOCH3, (R=-C6H5, -C6H4Me e -C6H4OMe), e
HX, (X=-F e -CN), correspondem a pontos de mínimo na curva de potencial, uma vez
que nenhuma frequência imaginária foi encontrada.
Através da Fig. 1, constatou-se que os comprimentos das ligações de hidrogênio
dos complexos envolvendo HF são menores do que os comprimentos dos complexos
envolvendo HCN. Por exemplo, para o complexo PhCOCH3···HF, os valores do
comprimento da ligação de hidrogênio são de 1.656 Å e 1.624 Å para os métodos
MP2 e B3LYP, respectivamente; já para o complexo correspondente com o ácido HCN,
PhCOCH3···HCN, os valores são de 2.006 Å e 2.000 Å para os métodos MP2 e B3LYP,
respectivamente. A Tab. 1 apresenta as principais mudanças estruturais ocorridas
devido à formação de ligação de hidrogênio nos referidos complexos. Em todos os
casos, foram observados que a formação da ligação de hidrogênio resultou em
aumento do comprimento das ligações H-X, (X= -F ou –CN), e C=O.
A Tab. 2 apresenta todos os valores de energia das ligações de hidrogênio com e
sem correções calculadas. De modo geral, através da Tab. 2 foi verificado que os
complexos RCOCH3, (R=-C6H5, -C6H4Me e -C6H4OMe), e HX, (X=-F e -CN), são
estáveis energeticamente. Por exemplo, para o complexo MeOPhCOCH3···HF, os
valores de ΔEBSSE, ZPE são de -23.5 kJ.mol-1 e -34.7 kJ.mol-1 para os métodos
MP2 e B3LYP, respectivamente. Para o complexo correspondente com o ácido HCN,
PhCOCH3···HCN, os valores são de -13.2 kJ.mol-1 e -20.6 kJ.mol-1 para os
métodos MP2 e B3LYP.
Figura 1.
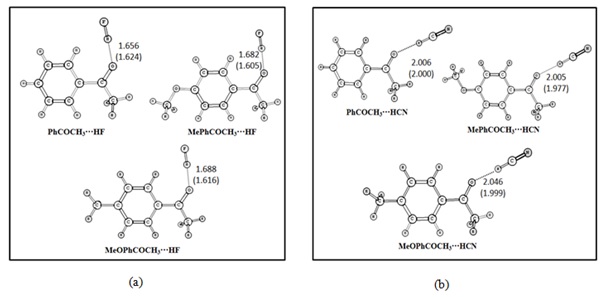
Geometrias otimizadas dos complexos entre RCOCH3 (R=
-C6H5, -C6H4Me, -C6H4OMe) e HX (X= -F e -CN).
CONCLUSÕES: Nossos cálculos foram realizados com sucesso na simulação dos modos vibracionais
dos complexos entre RCOCH3, (R=-C6H5,-C6H4Me e -C6H4OMe), e HX, (X=-F e –CN). Os
resultados revelaram que em todos os casos os valores das frequências de
infravermelho dos osciladores H-X deslocaram para menores valores e suas
respectivas intensidades aumentaram.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ e FACEPE pelo suporte financeiro e ao
LQTC.
REFERÊNCIAS BIBLIOGRÁFICA: [1] E. S. Kryachko, J. Mol. Struct., (2008), 880, 23.
[2] Belarmino, M. K. D. L.; Lima, N. B.D., Ramos, M. N., Int. J. of Qua. Chem. 112 (2012) 3246–3251.
[3] Nascimento, R. X. D.; Belarmino, M. K. D. L.; Lima, N. B.D., Int. J. of Qua. Chem. 112, (2012) 3147–3151
[4] C. Møller; M.S. Plesset, Phys. Rev., 46 (1934) 618.
[5] A.D. Becke, J. Chem. Phys. 1993, 98, 5648.
[6] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev. 2003, 103,1793.
