Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Iniciação Científica
TÍTULO: COMPROVAÇÃO DA EXISTÊNCIA DE LIGAÇÕES DE HIDROGÊNIO ENTRE LIGANTES NITROGENADOS E ÁCIDOS CARBOXÍLICOS POR FORTES E INESPERADOS EFEITOS EM RMN DE 1H
AUTORES: Ferreira da Cruz Santos, V. (UFPE) ; Adonias França, J. (UFPE) ; Bezerra de Lima, N. (UFPE)
RESUMO: Neste trabalho utilizamos cálculos teóricos para estudos associados à
interpretação das propriedades estruturais, energéticas e espectroscópicas de
complexos de hidrogênio entre compostos nitrogenados com diferentes ácidos
carboxílicos na proporção 1:1. Também realizamos estudos via espectroscopia de RMN
de 1H para comprovar a formação da ligação de hidrogênios nestes sistemas. Os
resultados teóricos mostraram que os complexos formados são estáveis
energeticamente, e que em todos os casos a complexação resultaria na blindagem
eletrônica dos núcleos de hidrogênio ácidos. Os resultados experimentais mostraram
que em todos os casos esta blindagem ocorria, exceto para o complexo entre 2,2’
bipiridina e ácido benzoico.
PALAVRAS CHAVES: RMN de 1H; ligações de hidrogênio; cálculos ab initio
INTRODUÇÃO: A formação de ligações de hidrogênio intermoleculares, ou seja, ligações de
hidrogênio entre diferentes moléculas causam mudanças importantes nas
propriedades energéticas, eletrônicas, estruturais e vibracionais destes
sistemas[1]. A ligação de hidrogênio por ser uma interação fraca quando
comparada com ligações covalentes e iônicas, é difícil de identificar a presença
de um sinal associado a ela em análises espectroscópicas, entretanto, uma
maneira eficiente de mostrar que ela está presente no sistema de interesse, é
verificar as mudanças nas propriedades espectroscópicas dos grupos que estão
próximos a ela.
Recentemente, foram reportados resultados computacionais associados ao estudo
das propriedades moleculares e espectroscópicas de complexos de hidrogênio
envolvendo compostos nitrogenados cíclicos e ácidos fluorídrico. Estes
resultados mostraram a possibilidade de formação de complexos estáveis
energeticamente entre essas moléculas, bem como as mudanças em suas propriedades
estruturais, energéticas e vibracionais, mostrando assim que os cálculos
computacionais revelaram informações importantes a respeito das propriedades
destes complexos[2-3].
Neste trabalho temos como objetivos realizar cálculos computacionais para
interpretar as propriedades estruturais, energéticas e espectroscópicas de
complexos envolvendo compostos nitrogenados cíclicos (1,10 fenantrolina e 2,2’
bipiridina) e ácidos carboxílicos (ácido fórmico, ácido acético e ácido
benzoico) nas proporções 1:1. A partir destas análises, realizaremos cálculos
GIAO para predizer os deslocamentos químicos teóricos bem como mostraremos como
experimentos via RMN de 1H podem ser utilizados para comprovar os efeitos da
formação da ligação de hidrogênio.
MATERIAL E MÉTODOS: Na parte computacional do trabalho, nós empregamos cálculos de orbitais
moleculares usando a teoria do funcional de densidade (DFT)[4] com o funcional
B3LYP[5] com o conjunto de funções base 6-31++G(d,p) para otimização completa
de geometria e o método GIAO para predição dos deslocamentos químicos teóricos.
Todos os cálculos foram realizados utilizando o programa de química quântica
computacional GAUSSIAN 2003.
Para a realização dos experimentos de RMN 1H, preparamos soluções contendo 1,10
fenantrolina ou 2,2 bipiridina e RCOOH em 0,51mL de CDCl3 na proporção 1:1.
Também realizamos análises das moléculas livres de complexação em solução de
CDCl3. Os experimentos de RMN de 1H foram realizados no equipamento VARIAN UNMRS
400 MHz.400 MHz. Nestes experimentos utilizamos um padrão de TMS com
deslocamento químico em 0 ppm. O campo magnético (B0) utilizado foi 7 T, também
foi utilizado um pulso de 45º e Lb=5Hz.
RESULTADOS E DISCUSSÃO: A figura 1 apresenta as geometrias otimizadas dos complexos estudados neste
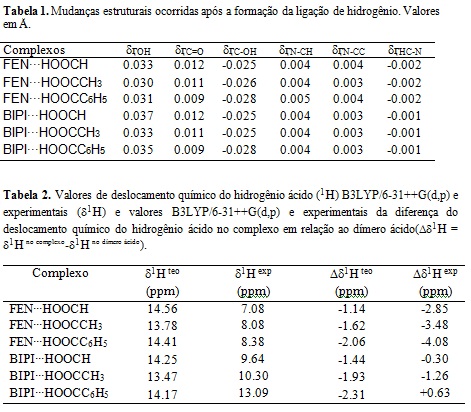
trabalho. A tabela 1 apresenta, as variações (δӷ) no tamanho de ligação dos
grupos O-H, C=O, N-CH, N-CC e HC-N. Quando verificamos os valores dos
comprimentos das ligações no complexo e na molécula livre de complexação,
observamos que em todos os casos as ligações O-H e C=O aumentaram, ou seja, este
fato indica que provavelmente a formação da ligação de hidrogênio, enfraqueceu
estas ligações.
A tabela 2 apresenta os resultados obtidos a partir dos cálculos computacionais
e análises experimentais de RMN de 1H. Através desta tabela, destacamos os
deslocamentos químicos associados ao núcleo de hidrogênio ácido (1H). Ao
analisar as consequências da formação da ligação de hidrogênio verificamos que
teoricamente a complexação resulta na blindagem dos hidrogênios ácidos, ou seja,
que a complexação ocasiona um aumento na densidade eletrônica presente nos
núcleos destes hidrogênios. Os resultados experimentais mostraram que para os
complexos envolvendo a 1,10 fenantrolina houve uma blindagem acentuada sendo a
maior delas de -4.08 ppm para o complexo FEN∙∙∙HOOCC6H5. Em relação aos
complexos envolvendo a 2,2’ bipiridina, observamos que para o complexo
BIPI∙∙∙HOOCC6H5 houve uma desblindagem (ΔδH1exp= +0.63 ppm), fato completamente
inesperado, uma vez que para os demais complexos houve uma blindagem eletrônica.
Por fim, nossos resultados experimentais comprovaram que além de haver a
formação da ligação de hidrogênio nestes complexos, a complexação modificou
bastante o deslocamento químico dos hidrogênios ácidos.
Figura 1.
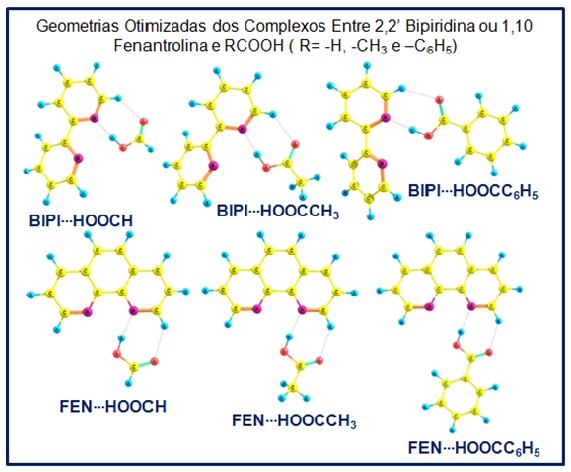
Geometrias otimizadas dos complexos entre os
ligantes nitrogenados e os ácidos carboxílicos.
CONCLUSÕES: Os cálculos computacionais mostraram que a formação de ligações de hidrogênio
entre as moléculas estudadas é possível, visto que, os complexos formados são
energeticamente estáveis e que nenhuma frequência imaginária foi encontrada.
As análises experimentais de RMN de 1H comprovaram que além de haver a formação da
ligação de hidrogênio nestes complexos, a complexação modificou bastante o
deslocamento químico dos hidrogênios ácidos. Em todos os casos observamos que o
núcleo de hidrogênio ácido é blindado após a complexação exceto para o complexo
BIPI∙∙∙HOOCC6H5.
AGRADECIMENTOS: Os autores agradecem a PROACAD, a PROPESQ, a UFPE, ao CNPQ e a FACEPE pelo suporte
financeiro e ao LQTC.
REFERÊNCIAS BIBLIOGRÁFICA: [1] J. Lin and P. A. Frey, J. Am. Chem. Soc., 122, (2000), 45, 11258.
[2] V. H. Rusu, M. N. Ramos, J. B. P. Silva, International Journal of Quantum Chemistry, 106, (2006), 2811.
[3] V. H. Rusu, M. N. Ramos, J. B. P. Silva, Vibrational Spectroscopy, 46, (2008) 52.
[4] G. J. Zhao, B. H. Northrop, K.L. Han, P. J. Stang, J Phys Chem A, 114, (2010), 9007.
[5] S. Jalili and M. Akhavan, J. Theor. Comput. Chem., 3, 4, (2004), 527
