Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: Iniciação Científica
TÍTULO: INVESTIGAÇÃO SOBRE AS PLANTAS ENDÊMICAS DA REGIÃO DA SERRA DA CAPIVARA E SEU USO POTENCIAL COMO CORANTES NATURAIS APLICÁVEIS NO ENSINO DE QUÍMICA
AUTORES: Mota, T.C. (UNIVASF/CAMPUS SÃO RAIMUNDO NONATO - PI) ; Mata, V.A. (UNIVASF/CAMPUS SÃO RAIMUNDO NONATO - PI) ; Marques, D.S.B. (CENTRO DE ENSINO MÉDIO EM TEMPO INTEGRAL (CEMTI –) ; Flores, V.L.F. (UNIDADE ESCOLAR EDITH NOBRE DE CASTRO) ; Cleophas, M.G.P. (UNIVASF/CAMPUS SÃO RAIMUNDO NONATO - PI)
RESUMO: Este trabalho teve como objetivo expor a importância da experimentação no Ensino
de Química, trabalhando a prática experimental com plantas regionais e de fácil
acesso. A proposta visa facilitar e contribuir para um melhor aprendizado dos
alunos, que devido à ausência da experimentação em sala, vem construindo uma visão
totalmente errônea do que é Ciência e qual sua verdadeira essência, logo, cria-se
uma espécie de bloqueio entre o aluno e a Química. Portanto, a idéia deste
trabalho é contextualizar o ensino de Química em sala de aula utilizando plantas
típicas da região Serra da Capivara, localizada na cidade de São Raimundo Nonato-
PI, como indicadores naturais de pH, enfatizando sua importância para a
experimentação, e fazendo elo com o cotidiano do aluno.
PALAVRAS CHAVES: Indicadores ácido-base; Ensino de Química; Extrato de plantas
INTRODUÇÃO: O uso de indicadores de pH é uma prática bem antiga que foi introduzida no
século XVII por Robert Boyle que, ao preparar um licor de violeta, observou a
mudança de coloração para vermelho em solução ácida e verde em solução. Assim
foram obtidos os primeiros indicadores de pH em papel e solução, logo, Boyle
definiu ácido como qualquer substância que torna vermelho os extratos de plantas
(TERCI e ROSSI, 2002). Vale ressaltar que nesta época, o conceito de ácidos e
bases ainda não estava formalizado.
É de suma importância da utilização de indicadores de pH para atividades
experimentais em sala de aula, seu uso tende a facilitar o aprendizado dos
alunos na identificação da acidez e da basicidade de diversas substâncias
diferentes, pois compreender o potencial hidrogeniônico (pH) é fundamental para
que o aluno possa estabelecer correlações entre outros temas importantes
abordados pela Química durante o ensino médio.
Segundo Justi e Ruas (1997, p-27), “Os alunos não estariam entendendo a Química
como um todo, mas como pedaços isolados de conhecimentos utilizáveis em
situações específicas. Estariam reproduzindo pedaços de conhecimento, mas não
aprendendo Química”. Atualmente, cabe ao professor auxiliar o aluno na tarefa
de formulação e de reformulação de conceitos, ativando o conhecimento prévio dos
alunos com uma introdução da matéria que articule esses conhecimentos à nova
informação que está sendo apresentada (POZO, 1998), e neste caso, a apropriação
da biodiversidade local, pode favorecer a aprendizagem, além de interligar
diferentes áreas do conhecimento, para que o aluno possa aprender Ciências de um
modo contextualizado e interdisciplinar. Este trabalho visa demonstrar que
utilizando as plantas da região, é possível ensinar Química de um modo fácil e
atrativo.
MATERIAL E MÉTODOS: O Parque Nacional da Serra da Capivara, declarado Patrimônio Cultural da
Humanidade pela UNESCO, está situado na microrregião de São Raimundo Nonato,
estado do PIAUÍ, abrange uma área de 92.228ha. Possui uma riqueza inestimável em
relação à biodiversidade e a sítios arqueológicos, contendo milhares de pinturas
rupestres, o mesmo está encravado na caatinga e sua história geológica,
climática e biológica é bastante complexa. Neste cenário, foram selecionadas
plantas nativas com intuito de testá-las quanto ao seu potencial para uso como
indicadores naturais de pH. Uma das plantas selecionadas foi o Cangalheiro
(Pterodonabruptus), facilmente encontrado nesta região. O extrato da referida
planta foi extraído em laboratório, seguindo os seguintes passos: a) Com o
auxilio de um almofariz com pistilo foi realizado o processo de maceração da
amostra; (b) Após macerada, cerca de 30g da amostra foi colocada em um becker
com aproximadamente 70 mL de água destilada, em seguida a mesma foi aquecida à
uma temperatura de 150°C e colocada em repouso por um período 24 horas; (c)
Depois de repousar por 24 horas, em temperatura ambiente, a amostra foi filtrada
para obtenção do seu extrato; (d) Depois de pronto, o extrato apresentou
coloração marrom escura e foi testado visando verificar sua eficácia como
indicador de soluções ácidas e básicas, como o HCl e o NaOH; (e) Finalmente,
após a comprovação da ação indicadora do estrato, o mesmo foi aplicado e testado
em soluções preparadas a partir da diluição de produtos caseiros utilizados em
nosso dia a dia (Tabela 1). Para cada solução utilizada foi determinado o seu
pH utilizando um pHmetro Hanna HI-221.
RESULTADOS E DISCUSSÃO: Ao adicionar nove gotas do extrato em cada uma das soluções, foi possível
observar a mudança da coloração no meio ácido ou básico (Figura 1), comprovando
assim a eficácia do Cangalheiro (Pterodonabruptus) como indicador alternativo de
pH para testes de acidez e basicidade. Conforme pode ser constatado, observando
o uso do indicador Cangalheiro, quando empregado em produtos caseiros, adquire
coloração vermelha em meio básico e coloração amarela em meio ácido (Tabela 1).
Este resultado pode contribuir significativamente para a experimentação em sala,
tornando-se uma alternativa para os professores da região, os quais não tem
acesso a laboratórios em suas escolas, o que desmotiva-os a inserir a
experimentação em suas aulas. No entanto, esta pesquisa visa demonstrar que com
planejamento e criatividade, é possível oferecer um ensino contextualizado ao
aluno, visando uma aprendizagem mais efetiva e menos arraigada nos problemas
inerentes as condições reais de ensino vivenciadas pelos professores.
A utilização de extrato natural indicador de pH pode ser explorada
didaticamente, desde a etapa de obtenção até a caracterização visual,
perpassando pelo contexto interdisciplinar. Com o indicador em questão, é
possível promover um ensino de Química mais dinâmico e devido a versatilidade
das diversas aplicabilidades do indicador, o mesmo pode ser utilizado para
ensinar diversos temas, tais como funções inorgânica, separação de misturas,
equilíbrio químico e iônico, etc. Del Pino e Lopes (1997) afirmam que “para o
ensino de Química ser eficiente e significativo, é preciso que os conteúdos
abordados reflitam a realidade cotidiana dos alunos, sem descuidar da
experimentação, a qual deve estar na base da metodologia adotada e pode ser
praticada com materiais de fácil aquisição”.
Tabela 1
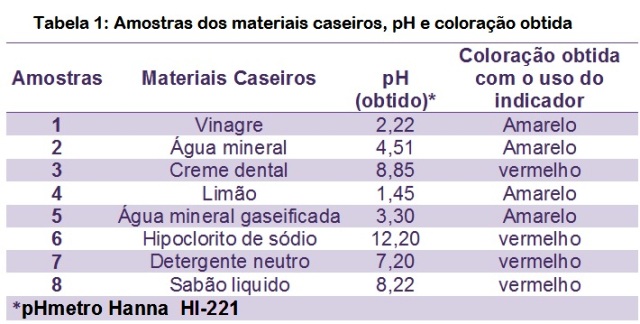
Amostras dos materiais caseiros, pH e coloração
obtida.
Figura 1

Amostras diluídas de materiais caseiros.
CONCLUSÕES: Diante dos resultados obtidos, pode-se concluir que o extrato bruto do Cangalheiro
apresenta potencialidade para a demonstração entre diferenciação do meio ácido e
básico, a partir da coloração exibida, atuando desta forma como indicador de pH.
Didaticamente, este indicador servirá para facilitar a abordagem de diferentes
temas relacionados à Química, além de contribuir para uma conjuntura
interdisciplinar, baseada na investigação e na exploração do Parque Nacional da
Serra da Capivara como meio de favorecer o ensino de Ciências, pautado na
criticidade dos alunos e na contextualização.
AGRADECIMENTOS: PIBIC/UNIVASF-EM, FAPEPI (Fundação de Amparo à Pesquisa do Estado do Piauí) e ao
POPEQUIM.
REFERÊNCIAS BIBLIOGRÁFICA: TERCI, D. B. L.; ROSSI, A. V. INDICADORES NATURAIS DE pH: USAR PAPEL OU SOLUÇÃO? Revista Química Nova, vol. 25, nº4, 684-688, 2002.
JUSTI, Rosária da Silva; RUAS, Rejane Mitraud. Aprendizagem de Química reprodução de pedaços isolados de conhecimento? Revista Química Nova na Escola, pesquisa n. 5,maio/1997, p.24-27.
POZO, J. I. Teorias Cognitivas da Aprendizagem. 3. ed. Porto Alegre: Artes médicas, 1998. 284p.
DEL PINO, J. C. ; LOPES, C. V. M. Uma Proposta para o Ensino de Química Construída na Realidade de Escola, Espaço da Escola, 25(4), 43-54, 1997.
