Realizado no Rio de Janeiro/RJ, de 14 a 18 de Outubro de 2013.
ISBN: 978-85-85905-06-4
ÁREA: FEPROQUIM - Feira de Projetos de Química
TÍTULO: Síntese do Mefenamato de Ferro III e sua Estequiometria a partir de Análise Térmica
AUTORES: Cardoso, M.Y. (IFMT - JUÍNA) ; Peruzzo, S. (IFMT - JUÍNA) ; Campos, F.X. (IFMT - JUÍNA)
RESUMO: Foi sintetizado, no estado sólido, o composto FeL3, sendo que L representa o íon
ânion mefenamato. O composto foi sintetizado por adição estequiométrica, sob
agitação do ligante, em forma de mefenamato de sódio, na solução de sulfato de
ferro III hexa-hidratado. A precipitação do composto ocorreu logo após a mistura
da solução do ligante e do metal, no entanto, houve a necessidade de se manter sob
refrigeração durante sete dias para o envelhecimento dos cristais. A
caracterização do composto foi realizada utilizando-se a Termogravimetria-
Calorimetria Exploratória Diferencial simultâneo (TG-DSC simultâneo). Através
desta técnica foi possível obter as informações sobre a desidratação,
comportamento térmico, estequiometria e a estrutura do composto sintetizado.
PALAVRAS CHAVES: estequiometria; mefenamato; comportamento térmico
INTRODUÇÃO: A análise térmica é uma técnica introduzida no Brasil na década de 60, na
ocasião, foram publicadas uma série de artigos sobre a decomposição térmica de
selenatos e selenitos de terras raras. A partir de 1974, com a introdução do
estudo das técnicas termoanalíticas em curso de pós-graduação em São Paulo
começou-se a difundir o estudo da Termogravimetria (TG), Análise Térmica
Diferencial (DTA) e a Calorimetria Exploratória Diferencial (DSC), com estes
estudos, focalizavam-se centralmente interpretações de dados termoanalíticos, o
que consolidou a utilização da Análise Térmica no Brasil (IONASHIRO, 2004).
Neste trabalho pretende-se sintetizar o composto de mefenamato de ferro III, a
partir do precursor mefenamato de sódio, previamente preparado a partir do ácido
mefenâmico. Descrever a utilização do cálculo estequiométrico como ferramenta
para se determinar a composição exata de uma substância a partir de dados
termoanalíticos. Espera-se determinar a partir da análise térmica TG-DSC
(Termogravimetria acoplada a Calorimetria Exploratória Diferencial) o grau de
hidratação e a decomposição térmica e a estequiometria da nova substância
sintetizada.
Não foi encontrado na literatura trabalhos sobre análise térmica de composto
mefanamato de ferro III com ênfase no cálculo estequiométrico utilizado na
definição de sua estrutura química.
Neste trabalho pretende-se sintetizar o composto mefenamato de sódio, como
precursor e o composto mefenamato de ferro III, além deste, pretende-se
caracterizar o composto mefenamato de ferro III através da Técnica
termoanalítica TG-DSC (termogravimetria – calorimetria exploratória
diferencial).
MATERIAL E MÉTODOS: O ligante mefenamato de sódio será preparado fazendo-se reagir
estequiometricamente o ácido mefenâmico, que possui o pKa igual a 4,2, (RASHEED
et al., 2009) com solução de hidróxido de sódio supondo a formação de uma
solução de mefenamato de sódio com concentração igual a 0,1 mol L-1, gerando uma
solução com pH ajustado em torno de 9,6. A partir dessas informações, será
determinada a quantidade a ser pesada de ácido mefenâmico, o qual será
dissolvido ou suspenso em uma determinada quantidade de água, e então, será
acrescentada lentamente uma solução contendo uma quantidade estequiométrica de
hidróxido de sódio. Para essa descrição de preparação possível do mefenamato de
sódio será testada a necessidade de aquecimento e agitação da mistura para
aperfeiçoar o processo.
Os mefenamato ferro III no estado sólido, será preparados pela adição
estequiométrica, lenta e sob agitação da solução do ligante mefenamato de sódio
na solução do respectivo cloreto ou sulfato de Ferro (III). Obtida a
precipitação, o conteúdo sólido será filtrado e lavado com papel de filtro
Whatman nº 42, lavado com água destilada até a eliminação total dos íons
cloretos ou sulfatos e recolhido em frasco de plástico (Ependorf) e mantidos em
dessecador.
Termogravimetria - calorimetria exploratória diferencial simultâneo (TG-DSC
simultâneo) será obtido no equipamento de análise térmica TG/DSC-1 da Mettler
Toledo capaz de operar desde a temperatura ambiente até 1600ºC. Para obtenção
das curvas, será utilizados cadinhos de α-Al2O3 (70μL), com massa de amostra em
torno de 10 mg, com razão de aquecimento de 20ºC min-1, atmosfera de ar seco com
vazão de 60 mL min-1 e intervalo de 30-1000ºC.
RESULTADOS E DISCUSSÃO: A preparação do ligante mefenamato de sódio rendeu uma solução com concentração
de 0,09500 mol L-1. A preparação do mefenamato de ferro III, ocorreu da mistura
do precursor com sulfato de ferro III hexa-hidratado, a mistura reagente
permaneceu por sete dias sob refrigeração até envelhecimento dos cristais, após
esse período o precipitado foi filtrado, lavado e seco resultando em um composto
sólido de cor marrom clara.Observando os dados da TG-DSC simultâneo, ver Figura
1, foi possível verificar que não há perda de massa na região entre 0 a 200 ºC
que seja significativa para determinar perda de água de hidratação ou água de
constituição do composto. Foi possível constatar que houve perda de massa de
88,90 %, relativa a decomposição oxidativa do mefenamato de ferro III até
formação de resíduo. Podemos observar, na Figura 1, que a decomposição térmica
do composto anidro ocorre em 3 etapas consecutivas. Os picos endotérmicos em 238
ºC e 265 ºC estão relacionados com a decomposição térmica do composto anidro. A
exoterma entre 350 ºC a 550 ºC com pico em 470 ºC é atribuída a decomposição
oxidativa da ligante orgânico. A curva TG-DSC indica a formação de Fe2O3
(ΔmTG=88,90%) em 560 ºC como resíduo estável, confirmado por teste qualitativo
realizado por observação da cor do resíduo que se apresentou avermelhado,
característico do Óxido Férrico. Cálculo estequiométrico do mefenamato de ferro
III, ver figura 2. A partir dela podemos definir que o composto é anidro e
possui a fórmula estequiométrica FeL3. Teor do mefenamato de ferro está
calculado conforme figura 3, no qual podemos afirmar que o composto foi
sintetizado com sucesso, pois há diferença entre o teor teórico e experimental
menor que 1%.
Curva TG-DSC do composto FeL3.
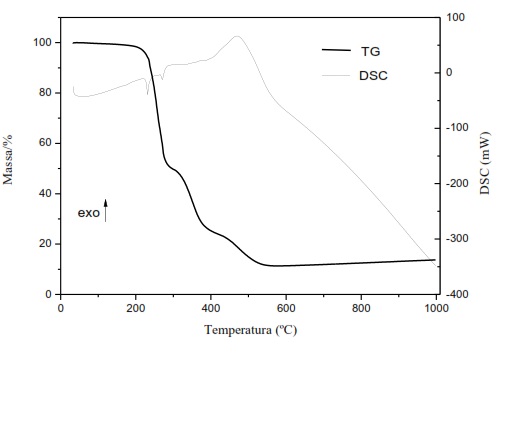
Análise térmica do mefenamato de ferro III através
de TG-DSC simultaneo.
Calculo estequiométrico do mefenamato de ferro III

Descreve a análise dos dados da curva TG utilizando
do cálculo estequiométrico para definir a composição
do mefenamato de ferro III.
Cálculo do teor de mefenamato de ferro III

Descreve o cálculo utilizado para comparar o teor
teórico e experimental de substância a partir da
análise térmica.
CONCLUSÕES: A partir das curvas TG-DSC foi possível estudar o comportamento térmico do
mefenamato de ferro III, determinar que o composto anidro e que sua fórmula geral
é FeL3. Demonstrar a forma de analisar os dados da curva TG para determinar a
estequiometria, fórmula e teor do composto sintetizado.
AGRADECIMENTOS: Ao professor Dr. Adriano Buzutti de Siqueira, pela análise térmica e
contribuições.
REFERÊNCIAS BIBLIOGRÁFICA: BANI-JABER, A.; HAMDAN, I.; AL-KHALIDI, B. Sodium mefenamato as a solution for the formulation and dissolution problems of mefenâmico acid. Chemical and Pharmaceutical Bulletin. v. 55, p. 1136 – 1140, 2007.
BOJAROWICZ, H.; KOKOT, Z.; SURDYKOWSKI, A. Complexes of Fe(III) ions with mefenamic acid. Journal of Pharmaceutical and Biomedical Analysis. v. 15, p. 339 – 342, 1996.
BRZYSKA, W.; OZGA, W. Thermal decomposition of yttrium and lanthanide complexes with mephenamic acid. Thermochimica Acta. v. 195, p 149 – 155, 1992.
Campos, F. X. - “Síntese e caracterização do ácido mefenâmico com manganês II, ferro II, cobalto II, níquel II, cobre II, e zinco II”, Dissertação de Mestrado, Universidade Federal de Mato Grosso, Cuiabá Brasil (2012).
DIMIZA, F.; PAPADOPOULOS, A. N.; TANGOULIS, V.; PSYCHARIS, V.; RAPTOPOULOU, C. P.; KESSISSOGLOU, D. P.; PSOMAS, G. Biological evoluation of non-steroidal anti-inflammatory drogs-cobalt(II) complexes. Dalton Transactions. v. 39, p. 4517 – 4528, 2010.
DIMIZA, F.; FOUNTOULAKI, S.; PAPADOPOULOS, A. N.; KONTOGIORGIS, C. A.; TANGOULIS, V.; RAPTOPOULOU, C. P.; PSYCHARIS, V.; TERZIS, A.; KESSISSOGLOU, D. P.; PSOMAS, G. Non-steroidal antiinflammatory drug-copper(II) complexes: Struture and biological perspectives. Dalton Transactions. v. 40, p. 8555 – 8568, 2011.
DUVAL, C. Inorganic thermogravimetric analysis. Amsterdam – London – New York: Elsevier Publishing company, 1963.
IONASHIRO, M. Giolito – Fundamentos da termogravimetria, análise térmica diferencial, calorimetria exploratória diferencial. Araraquara – SP: Giz editorial, 2004.
KOVALA-DEMERTZI, D.; HADJIPAVLOU-LITINA, D.; STANINSKA, M.; PRIMIKIRI, A.; KOTOGLOU, C.; DEMERTZIS, M. A. Anti-oxidant, in vitro, in vivo anti-inflammatory activity and antiproliferative activity of mefenamic acid and ists metal complexes with manganese (II), cobalt (II), nickel (II), copper (II) and zinc (II). Journal of Enzyme Inhibition and Medicinal Chemistry. v. 24, n. 3, 742-752, 2009.
KRUSZYNSKI, R.; TRZESOWSKA-KRUSZYNSKA, A.; MAJEWSKI, P.; LUKASZEWICZ, E.; MAJEWSKA, K.; SIERANSKI, T.; LEWINSKI, B. Struture and properties of the sodium, potassium and calcium salts of 2-(2,3-dimehtylphenyl)aminobenzoic acid. Journal of Molecular Struture. v. 970, p. 79 – 89, 2010.
MELNÍK, M.; KOMAN, M.; MACÁSKOVÁ, L.; GLOWIAK, T. Spectral and magnetic study of copper(II) mefanamates: Crystal and molecular structure of bis(mefanamato)di(N,N-diethylnicotinamide)di(aqua)copper(II). Journal of Coordination Chemistry. v. 44, p. 163 – 172, 1998.
RASHEED, A.; KUMAR A. C. K. Synthesis, hydrolysis and pharmacodynamic profiles of novel prodrugs of mefenamic acid. International Journal of Current Pharmaceutical Research. v. 1, p. 47 – 55, 2009.
THE UNITED STATES PHARMACOPEIA (USP). Pharmacopeial convention. United States of America, 2010.
